4.2 Summenformel
Ein Thema, was häufig etwas mehr Schwierigkeiten macht ist das richtige Erstellen von Summenformeln. Erschwert wird das ganze durch die „Faulheit der Chemiker“:
Bei chemischen Reaktionsgleichungen und Formeln wird selten eine allein stehende 1 geschrieben. Meistens wird sie weggelassen (denkt sie euch aber dazu).
Die Summenformel zeigt an aus welchen und wie viel Atomen ein Molekül besteht. Dabei schreibt man die Elementsymbole hin. Im Index hinter dem Elementsymbol schreibt dann noch die Anzahl der Atome eines Elements in arabischen Ziffern.
Vorgehensweise zum Erstellen einer Summenformel
- Alle Elementsymbole hinschreiben aus denen ein Molekül besteht.
- Die Anzahl der Atome eines Elements zählen.
- Die Anzahl im Index hinter das Elementsymbol schreiben. (Falls es eine 1 ist, die 1 weglassen).
Beispiel: Wasser
- Schritt: H O (hinschreiben)
- Schritt: Wasser besteht aus 2 Hs und 1 O
- Schritt: H₂O₁ => faule, also richtige Schreibweise: H₂O
In kurz:
Jetzt kommen wir zu ein paar Übungen. Zunächst wiederholen wir die HNO-Regel.
Zeichnet die Summenformel wie auch die Strukturformel als Übung für folgende Elemente:
Element Wasserstoff
{slider title="Lösung" open="false" class="icon"}
H₂
{/sliders}
Element Stickstoff
{slider title="Lösung" open="false" class="icon"}
N₂
{/sliders}
Element Chlor
{slider title="Lösung" open="false" class="icon"}
Cl₂
{/sliders}
Bevor wir zu etwas komplexeren Molekülen kommen möchte ich noch eine andere Ziffer einführen. Manchmal hat man ja nicht nur ein Molekül, sondern 2, 3, 4, … (bzw um eine realistische Zahl zu haben 1 mol, 2 mol, 3 mol, ...). Diese Ziffer schreiben wir vor der Summenformel.
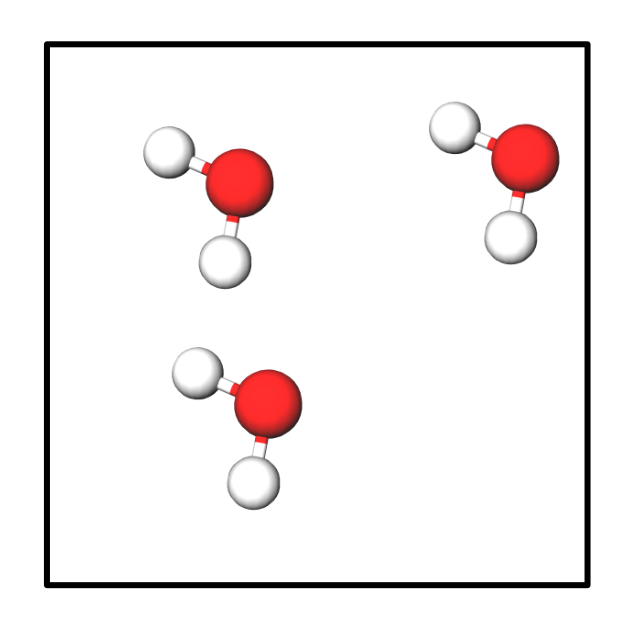
Bsp.: Ich habe in einem Behälter folgende Anzahl an Wassermoleküle:
Ergebnis:
{slider title="Lösung" open="false" class="icon"}
3 H₂O
{/sliders}
Wichtig ist es, den Unterschied zu verstehen, wann eine Zahl in den Index kommt und wann davor.
Hier einmal zwei Beispiele:
In einem Gefäß sind 3 Wasserstoff-Moleküle:
Schreibe die dazu passende Summenformel:
{slider title="Lösung" open="false" class="icon"}
3 H₂
{/sliders}
In einem Gefäß sind 6 Wasserstoff-Atome, ohne dass sie als Molekül gebunden sind:
{slider title="Lösung" open="false" class="icon"}
6 H₁ => denkt an die faule Schreibweise: 6 H (da man keine 1 schreibt).
{/sliders}
Ihr seht, dass in beiden Behältern jeweis 6 H-Atome drin sind; allerdings ist es nicht das gleiche. Und das muss man auch an den Summenformeln erkennen.
Weitere Beispiele:
Schreibe die Summenformel für folgende Verbindungen:
{slider title="Lösung" open="false" class="icon"}
C₁H₄ => CH₄ (= Methan, ein Molekül welches aus 1 C-Atom und 4 H-Atomen besteht.
{/sliders}
{slider title="Lösung" open="false" class="icon"}
Lösung: Cl₂
{/sliders}
{slider title="Lösung" open="false" class="icon"}
Lösung: P₄
{/sliders}
Und zum Abschluss noch zwei Moleküle Ammoniak:
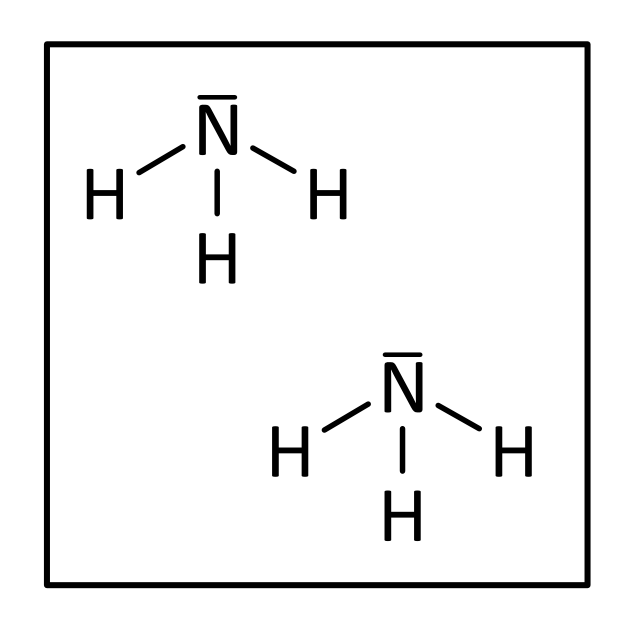 bzw.
bzw. 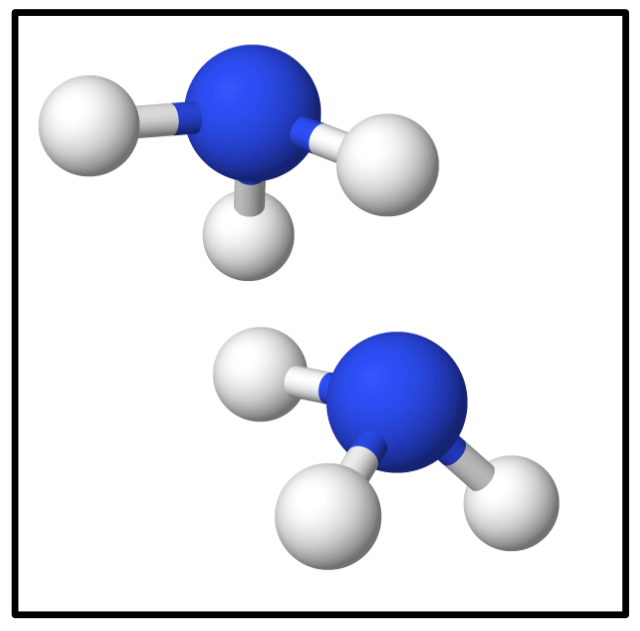
{slider title="Lösung" open="false" class="icon"}
Lösung: 2 N₁H₃ bzw. richtig: 2 NH₃
{/sliders}
Beim nächsten Thema führen wir das gelernte (Strukturformeln und Summenformeln) bei den Reaktionsgleichungen zusammen.