8 Enthalpie - H
8.1 Exotherme Reaktionen bzw. Vorgänge
Einige Beispiele:
a) Natriumhydroxid wird in Wasser gelöst
NaOH(s) + H₂O (l) → Na¹⁺(aq) + OH⁻(aq) + H₂O(l)
Die Hydrationsenthalpie ist größer als die Gitterenthalpie.
b) Konzentrierte Schwefelsäure wird zu Wasser gegeben
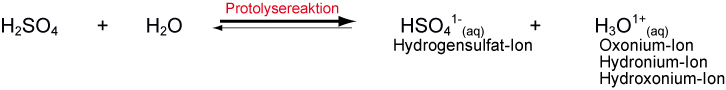
c) Ein Gemisch aus Eisen und Schwefel wird kurz erhitzt
(heißer Draht)
![]()
Auswertung der Versuche Bei allen 3 Versuchen wird Energie in Form von Wärme an die Umgebung abgegeben. Die Reaktionen a) und b) laufen spontan ab, die Reaktion c) ist „gehemmt“ und muss erst aktiviert werden. Das System verarmt dabei an Energie. Die vom System abgegebene Energie wird mit negativen Vorzeichen angegeben. Reaktionen, bei denen Wärme an die Umgebung abgegeben wird, nennt man exotherm.
Bei allen 3 Versuchen wird Energie in Form von Wärme an die Umgebung abgegeben. Die Reaktionen a) und b) laufen spontan ab, die Reaktion c) ist „gehemmt“ und muss erst aktiviert werden. Das System verarmt dabei an Energie. Die vom System abgegebene Energie wird mit negativen Vorzeichen angegeben. Reaktionen, bei denen Wärme an die Umgebung abgegeben wird, nennt man exotherm.
Merke: Die Reaktionswärme, die bei konstantem äußerem Druck ausgetauscht wird, bezeichnet man als Reaktionsenthalpie (Symbol ΔH).
Allgemeines Beispiel:
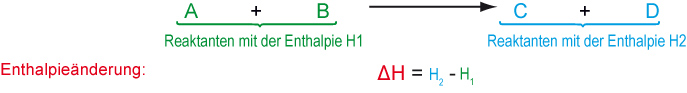
Bei exothermen Reaktionen ist die Reaktionsenthalpie ΔH negative.
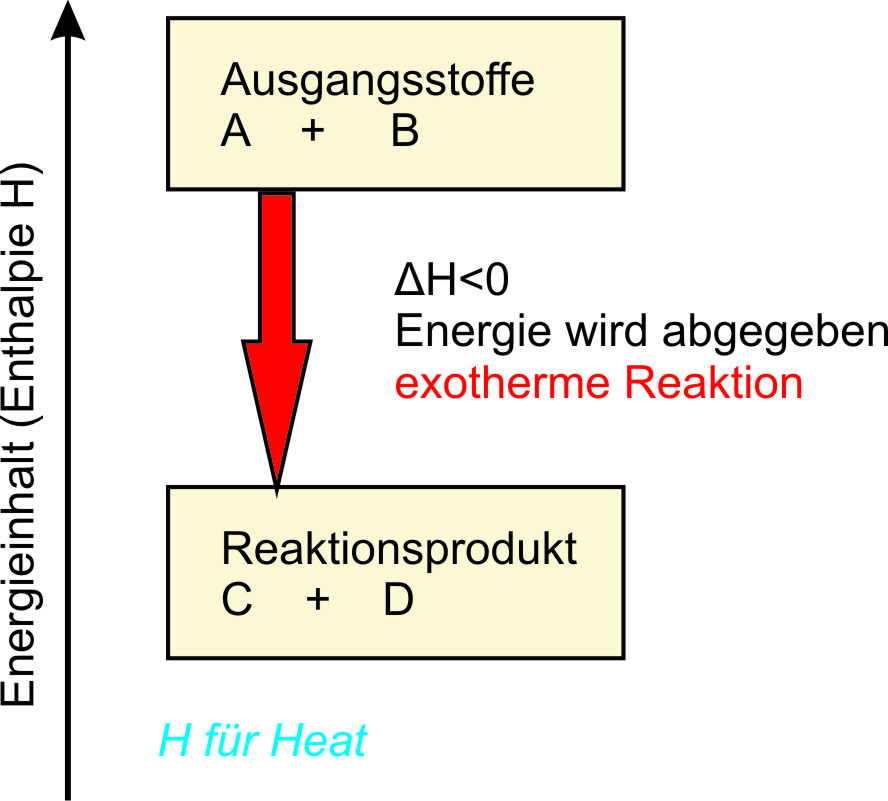
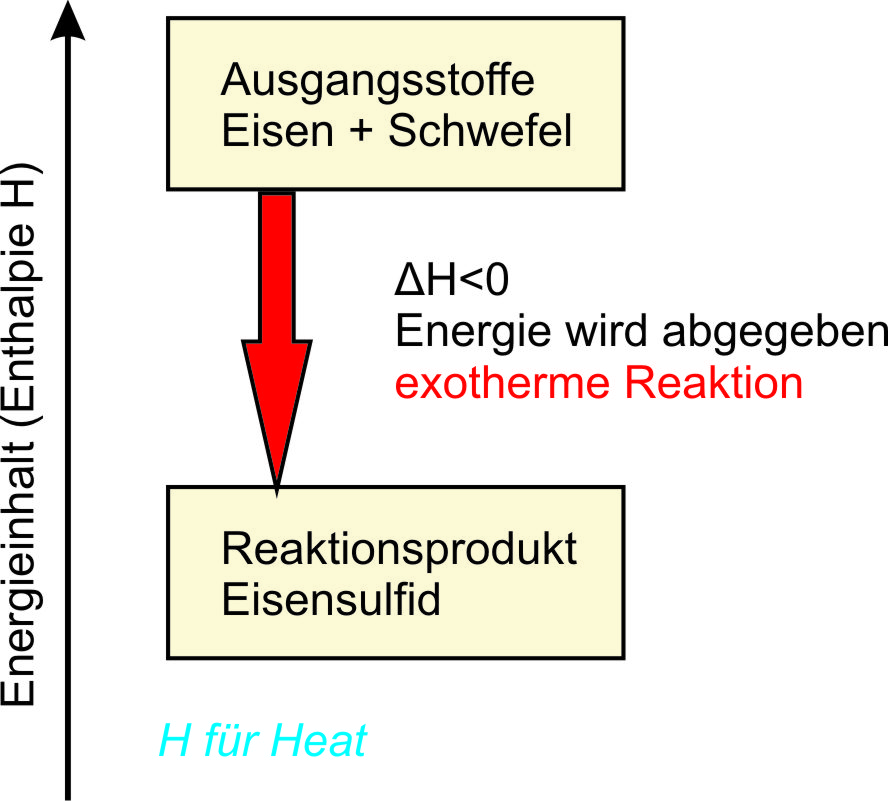
Bsp.: Enthalpieschema (ohne Aktivierungsenergie):
links: allgemeines Schema; rechts für die Reaktion von Eisen mit Schwefel.
Bsp.: Enthalpieschema mit Reaktionsverlauf und Aktivierungsenergie
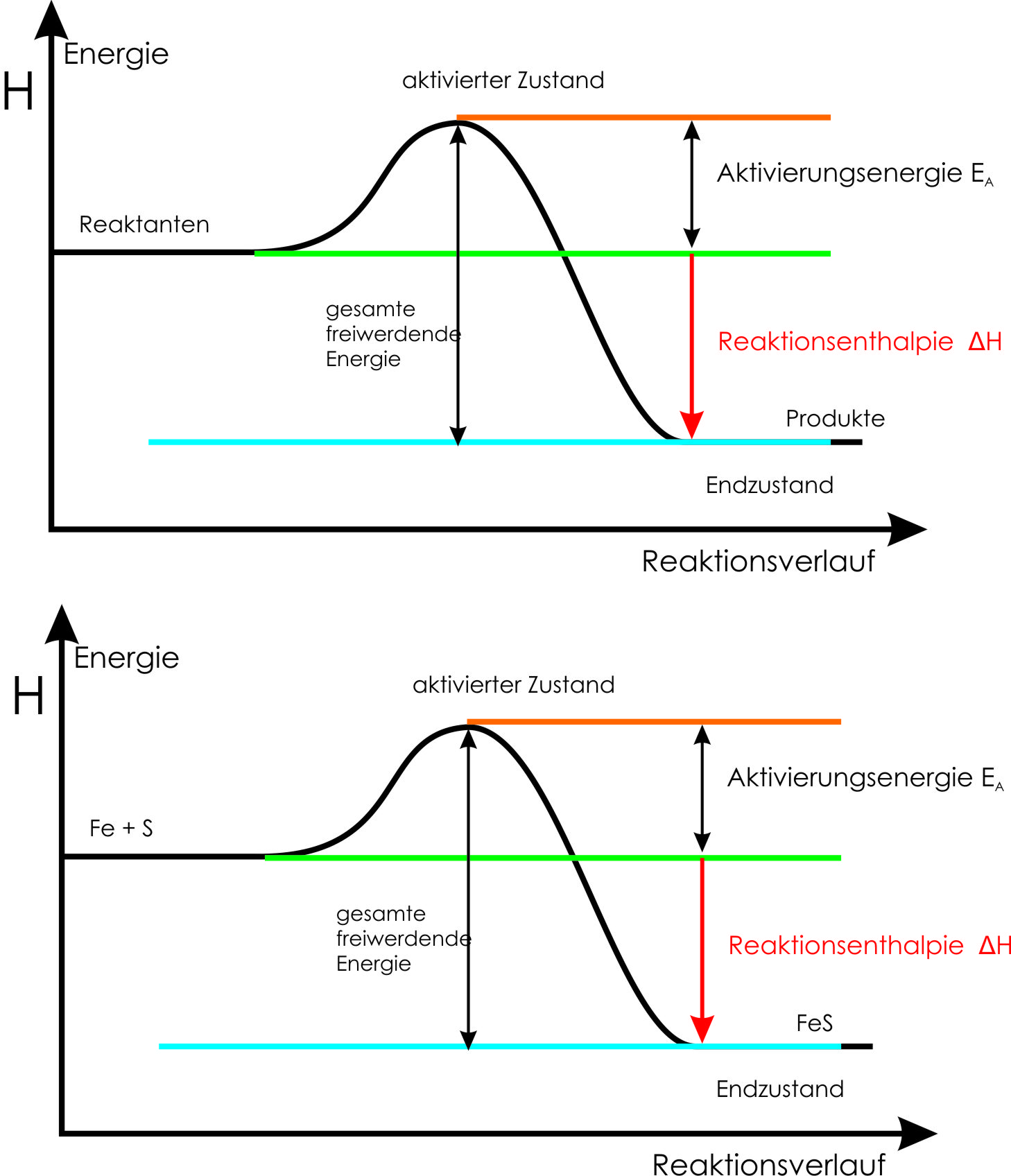
ΔH < 0 ⇨ exotherm (aber gehemmte) Reaktion (vgl. Metastabile Verbindungen).
Merke: Bei exothermen Vorgängen ist der Endzustand energieärmer als der Ausgangszustand.
Prinzip von Thomson und Berthelot (= Energieprinzip)
Die Wärmetönung stellt ein Maß für die Affinität (Triebkraft) einer chemischen Reaktion dar. Es laufen die Prozesse (Vorgänge, Reaktionen) ab, die zu einem energieärmeren Zustand führen.
Andere Formulierung: Die Systeme streben einem Minimum an Enthalpie entgegen (bei konstantem Druck).
Achtung: Diese Aussage trifft jedoch nur bei einseitig verlaufenden Reaktionen zu, steht aber im Widerspruch mit den Gleichgewichtsreaktionen, die in bestimmten Zustandsbereichen auch im entgegen gesetzten Sinne erfolgen.
