4.5 Akkumulatoren
Wiederaufladbar
Vgl. Bleiakku
4.5.1 Lithium-Ionen-Akkumulator
Minuspol: Lithium
Vorteil: Unedel, Leichtmetall
Nachteil: reagiert mit Wasser → nichtwässrige Elektrolyte
Elektrode: Edelstahl
Pluspol (Oxidationsmittel): Chromoxid (CrOx), Braunstein (MnO₂), Thionylchlorid (SOCl₂), Bismutoxid (Bi₂O₃)
Formuliert für den Minuspol einmal die Halbreaktion
{slider title="Lösung" open="false" class="icon"}
Minuspol: Li (s) → Li⁺ + e⁻
{/sliders}
Pluspol: ![]() (bzw. LiMn₂O₄)
(bzw. LiMn₂O₄)
⇨ Lithium wird in das Mangandioxid-Gitter eingelagert.
Elektrolyt: Organische Lösungsmittel (Propylencarbonat oder Demthoxyethan) mit Lösung von Lithiumperchlorat (LiClO₄)
Geringe Selbstentladung, bei geringe Entladeströme bis zu 10 Jahre nutzbar ⇨ EDV als Datenspeicher
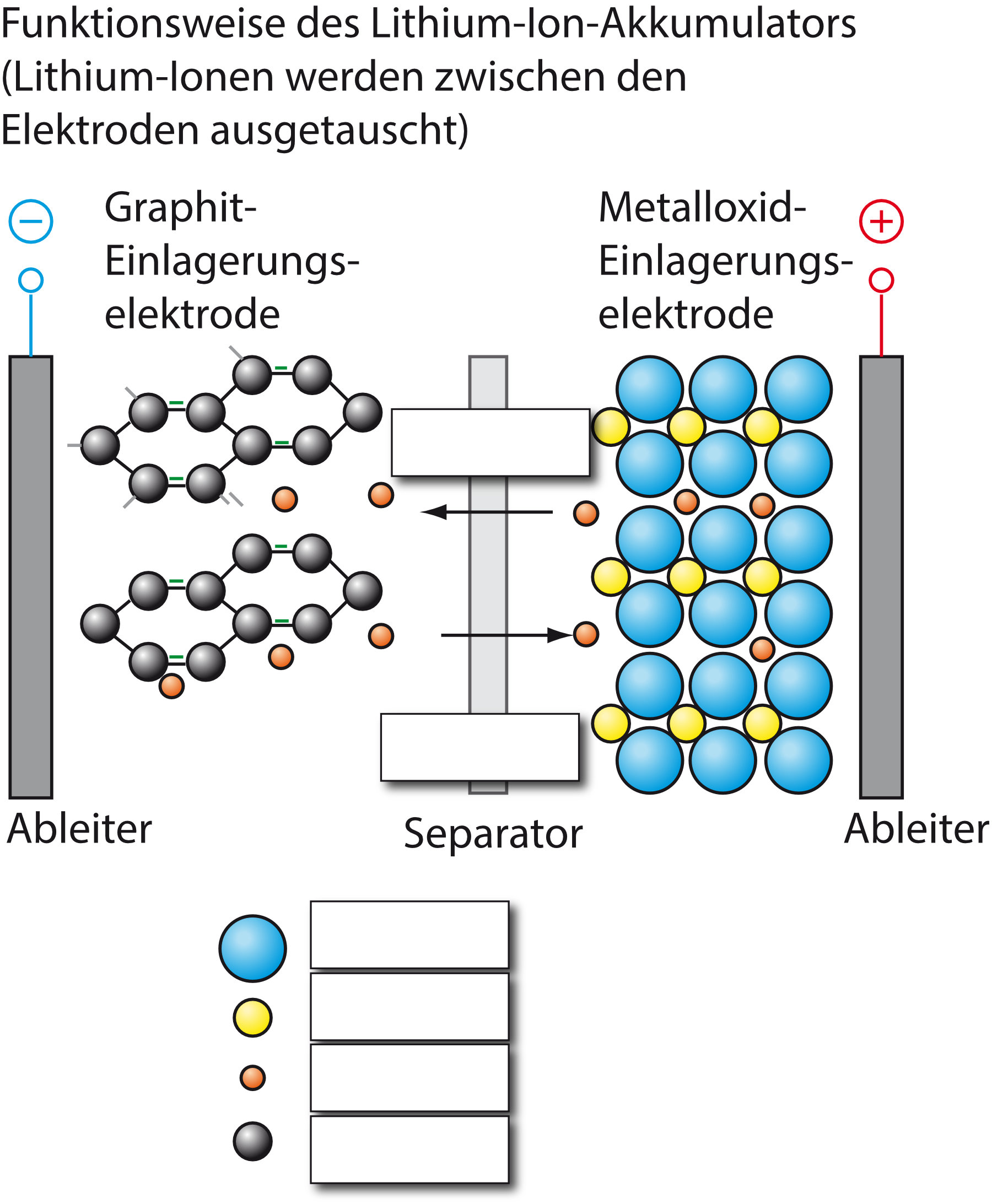
Beschrifte folgende Abbildung:
{slider title="Lösung" open="false" class="icon"}
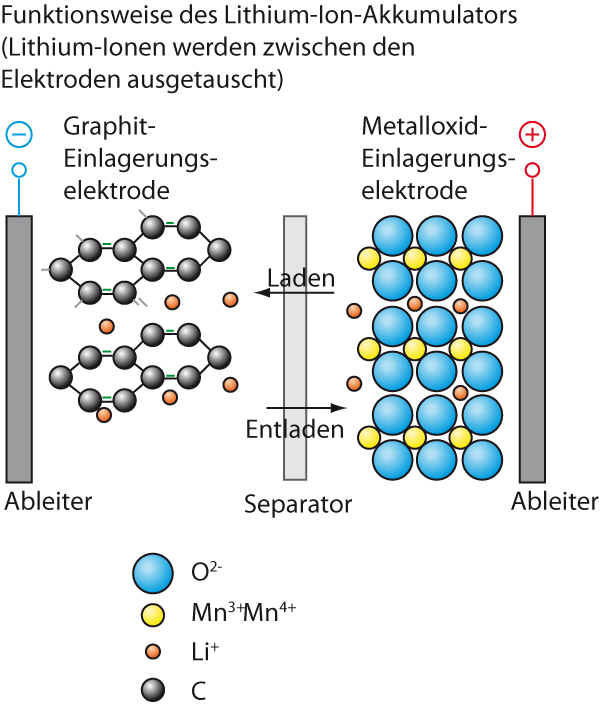
{/sliders}
4.5.2 Nickel/Cadmium-Akkumulator
Geladener Zustand
Minuspol: fein verteiltes Cadmium
Pluspol: Nickel(III)-oxidhydroxid
Nicht ganz einfach: Formuliert mal den Entladevorgang:
{slider title="Lösung" open="false" class="icon"}
Minuspol: Cd (s) + 2 OH⁻ (aq) → Cd(OH)₂ (s) + 2 e⁻
Pluspol: 2 NiOOH (s) + 2 H₂O (l) + 2 e⁻ → 2 Ni(OH)₂ + 2 OH⁻
{/sliders}
Problem: giftiges Cadmium (Recycling)
4.5.3 Nickel/Metallhydrid-Akkumulator
Besonderheit: Metalllegierung (La, Ni, Co, Si, Cr, Mo, Co), welches reversibel Wasserstoff speichern kann.
Wirklich schwierig. Deshalb schaut es euch erst einmal an und versucht es dann erst zu lösen.
{slider title="Lösung" open="false" class="icon"}
Minuspol: Metall-H₂(s) + 2 OH⁻ (aq) → Metall + 2 H₂O (l) + 2 e⁻
Pluspol: 2 NiOOH (s) + 2 H₂O (l) + 2 e⁻ → 2 Ni(OH)₂ + 2 OH⁻
-----------------------------------------------------------------------------------------
Zellreaktion: Metall-H₂ (s) + 2 NiOOH (s) →Metall + 2 Ni(OH)₂ (s)
{/sliders}
Dass Metall nicht oxidiert werden (am Ende der Entladung) wird negative Elektrode überdimensioniert.