3 Edelgasregel
{slider title="Link zur interaktiven Übungsseite mit Bildern" open="false" class="icon"}
{/sliders}
Problem: Wie kann man die Summenformel der Synthese von Wasser ableiten? 2 H₂ (g) + O₂ (g) → 2 H₂O (l)
Teilproblem: Warum liegen Edelgase atomar vor, während gasförmige Elemente molekular vorliegen?
Edelgas-Atome besitzen eine Elektronenhülle mit vollständig besetzter Außenschale. Diese Elektronenverteilung, die Edelgaskonfiguration, ist besonders günstig. Edelgas-Atome gehen deshalb kaum Bindungen ein.
Elemente anderer Hauptgruppen sind bestrebt, die „Edelgaskonfiguration“ zu erreichen und bilden deshalb Moleküle.
Edelgas-Regel: Atome sind bestrebt, die Elektronenkonfiguration der Edelgase zu erreichen.
Bsp.: Wasserstoffatom im H₂-Molekül besitzt die Elektronenkonfiguration von Helium (2 Valenzelektronen).
„Oktett“-Regel: Bei Nichtmetall-Atomen ist in Molekülen die Gesamtzahl der bindende und der nichtbindenden Elektronen in der Regel acht. Ein Atom hat dann Edelgaskonfiguration, wenn es 4 Elektronenpaare in der Valenzschale besitzt.
Bsp.: Fluoratom (vgl. Tabelle) im F₂-Molekül besitzt die Elektronenkonfiguration von Neon.
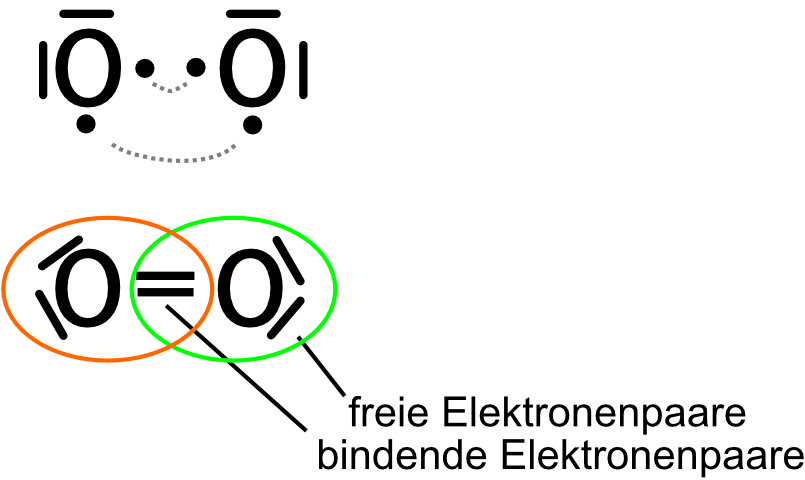
Übung: Wie erfüllt das Sauerstoff-Molekül diese Regel? O₂
{slider title="Lösung" open="false" class="icon"}
{/sliders}
Das ist vielleicht noch etwas schwierig zu verstehen, aber spätestens beim nächsten Thema, der Atombindung, wird es klarer. ?