5 Stärke von Säuren und Basen - Säurestärke und Molekülstruktur
Hinweis 1: Das Kapitel stammt aus dem Oberstufenbereich. Ich halte es für das Verständnis für Säure-Base-Reaktionen wichtig, weil man sonst bei einer Reaktion mit zwei Ampholyten (z.B. Wasser und Ammoniak) gar nicht weiß, wer die Säure ist und wer als Base funktioniert.
Hinweis 2: Auch hier ist es von Vorteil, wenn man ein Periodensystem der Elemente zur Hand hat.
Brønsted-Theorie:
Säurestärke ist die Tendenz Protonen abzugeben.
Basenstärke Tendenz Protonen aufzunehmen.
Bsp. HCl + H₂O → H₃O⁺ + Cl⁻
Säure 1 Base 2 Säure 2 Base 1
Info: Supersäuren = Säuren die stärker als H₂SO₄ sind.
Je stärker die Säure desto schwächer die konjugierte (korrespondierende) Base.
5.1 Binäre Säuren.
Faktoren für Säurestärke von Bedeutung:
- Elektronegativität (innerhalb einer Periode)
- Atomgröße (innerhalb einer Gruppe)
a) innerhalb einer Periode (binäre H-Verbindungen)
Säurestärke nimmt mit der EN zu (Atomgrößenunterschiede sind „zu“ gering)
⇨ Elektronen werden stärker dem H-Atom entzogen ⇨ erleichterte Protonenabspaltung.
Bsp.:
2. Periode:
Zunahme der EN: N < O < F
Zunahme der Säurestärke NH₃ < H₂O < HF
Gegenüber Wasser Base Säure
3. Periode
Zunahme der EN: P < S < Cl
Zunahme der Säurestärke PH₃ < H₂S < HCl
b) innerhalb einer Gruppe (binäre H-Verbindungen):
Säurestärke nimmt mit der Atomgröße zu (stärkere Auswirkung als Elektronegativität)
⇨ bei einem großen Atom ist die Valenzelektronenwolke auf einem größeren Raum verteilt ⇨ H⁺ ist weniger fest gebunden.
H₂O < H₂S < H₂Se < H₂Te
HF < HCl < HBr < HI
5.2 Oxosäuren
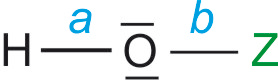
Sauerstoff hat in etwa die gleiche Größe
a) EN von Z ist entscheidend.
Je größer die EN von Z, desto stärker ist die Säure (-I-Effekt).
HOI < HOBr < HOCl
hyopoiodige Säure hypobromige hypochlorige Säure
b) An Z sind weitere O-Atome gebunden ⇨ stärkerer –I-Effekt (bzw. höhere Formalladung am Z. )
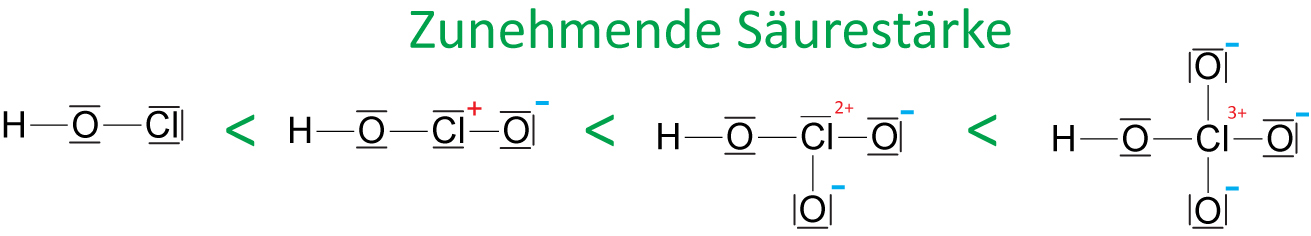
hypochlorige – chlorige – Chlor – Perchlorsäuren
⇨ Man kann Säurestärke abschätzen: Je mehr mehr O-Atome an das Z-Atom jedoch nicht an H-Atom gebunden sind, desto die Säure:
H-O-NO < H-O-NO₂
salpetrige Säure Salpetersäure
(H-O-)₂SO < (H-O-)₂SO₂
schweflige Säure Schwefelsäure
