8.2 Endotherme Reaktionen bzw. Vorgänge
Einige Beispiele:
a) H₂O (s) → H₂O (l)
b) Ammoniumnitrat (oder Ammoniumchlorid) wird in Wasser gelöst
NH₄NO₃ (s) + H₂O (l) → NH₄⁺ (aq) + NO₃¹⁻ (aq)
Ammoniumnitrat Ammonium-Ion Nitrat-Ion
c) Bariumhydroxid und Ammoniumthiocyanat (Ammoniumrhodanid)
Ba(OH)₂ ∙ 8 H₂O(s) + 2 NH₄SCN(s) → Ba²⁺ (aq) + 2 SCN⁻ (aq) + 2 NH₃ (g) + 10 H₂O(l)
Unter Gasentwicklung verflüssigt sich die feste Mischung und erstarrt wieder. Es wird eine starke Abkühlung des Systems beobachtet.
Auswertung der Versuche:  Bei allen drei Beispielen wird vom System Wärme aus der Umgebung aufgenommen. Die Umgebung kühlt sich bei diesen Vorgängen ab. Das System erhöht seinen Energieinhalt.
Bei allen drei Beispielen wird vom System Wärme aus der Umgebung aufgenommen. Die Umgebung kühlt sich bei diesen Vorgängen ab. Das System erhöht seinen Energieinhalt.
Die vom System aufgenommene Energie wird mit einem positiven Vorzeichen angegeben. Reaktionen, bei denen Wärme aus der Umgebung aufgenommen wird, nennt man endotherm.
Bei endothermen Reaktionen ist die Reaktionsenthalpie ΔH positiv.
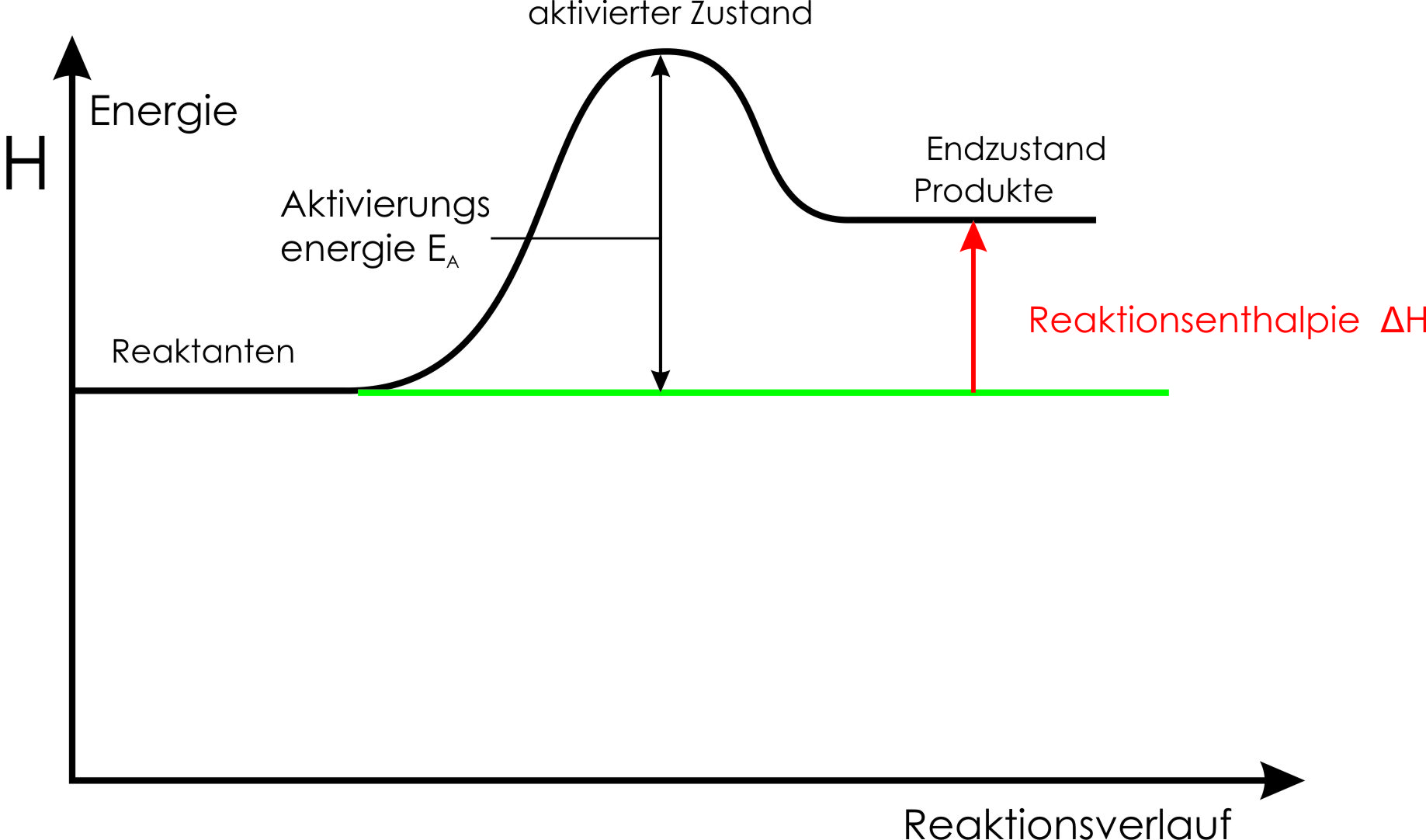
ΔH > 0 ⇨ endotherm (gehemmte Reaktion)
Merke: Bei endothermen Reaktionen (Vorgängen) ist der Endzustand energiereicher als der Ausgangszustand.
