4.7.6 Korrosionsschutz
⇨ vgl AB
4.7.7 Galvanisation
⇨ vgl. AB
Unter Galvanisieren versteht man das elektrolytische Überziehen von unedlen Metallen mit haftenden Schichten glänzender, edler Metalle.
Die metallische Überzüge dienen u.a. als Korrosionsschutz und als Oberflächenvergütung.
Prinzip:
Schaltet man einen metallischen Gegenstand als Kathode (⇨ Reduktion) in den Stromkreis, so lässt sich dieser vergolden, verkupfern oder vernickeln, wenn man als Anode eine Elektrode aus dem jeweiligen Metall einschaltet und als Elektrolyten die entsprechende Metallsalzlösung wählt. Die Werkstücke müssen jedoch vorher von Schmutz (Fett) und Oxidschicht befreit werden.
Verzinkung von Stahlblechen (z.B. für das Auto)
Durch Elektrolyse lassen sich Stahlbleche verzinken. Als Anode dient eine Zinkelektrode. Das Stahlblech taucht in eine Zinksalzlösung und wird als Kathode geschaltet.
4.7.8 Das Eloxal-Verfahren
Aluminium ist ein unedles Metall (Normalpotential E° = - 1,66 V); es erweist sich an der Luft jedoch als stabil. Dies liegt daran, dass sich Aluminium an der Luft mit einer zusammenhängenden Oxidschicht überzieht.
Durch die elektrolytische Oxidation von Aluminium kann diese natürliche Oxidschicht verstärkt werden.
Versuch:
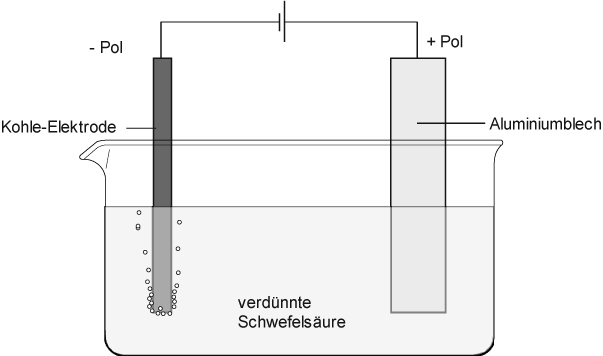
Das Aluminium wird bei der Elektrolyse als Pluspol, der Kohlestab als Minuspol geschaltet. Die Spannung beträgt etwa 15 Volt.
Beobachtung:
An der Kathode entsteht ein Gas.
Vereinfachte Auswertung:
Anode: + Pol: __________________________________________
Diese _______-Ionen wandern durch die feine Poren der natürlichen Oxidschicht zum Elektrolyten. Vermutlich tritt dort folgende Reaktion ein:
________________________________________________
Ein Teil des Elektrodenmaterials wird aufgelöst. Gleichzeitig bildet sich ständig Al₂O₃. Diese Schicht wächst in das Metall hinein.
Kathode: - Pol: ________________________________________________
{slider title="Lösung" open="false" class="icon"}
Das Aluminium wird bei der Elektrolyse als Pluspol, der Kohlestab als Minuspol geschaltet. Die Spannung beträgt etwa 15 Volt.
Beobachtung:
An der Kathode entsteht ein Gas.
Vereinfachte Auswertung:
Anode: + Pol: _______Al → Al³⁺ + 3 e⁻ _______________
Diese ___Al³⁺-Ionen wandern durch die feine Poren der natürlichen Oxidschicht zum Elektrolyten. Vermutlich tritt dort folgende Reaktion ein:
________2 Al³⁺ + 3 H₂O → Al₂O₃ + 6 H⁺ ________
Ein Teil des Elektrodenmaterials wird aufgelöst. Gleichzeitig bildet sich ständig Al₂O₃. Diese Schicht wächst in das Metall hinein.
Kathode: - Pol: _______2 H₃O⁺ + 2 e⁻ → H₂ + 2 H₂O ______
{/sliders}
