2.13.2 Ermittlung der GG-Konstanten Kc aus den gemessenen Konzentrationen
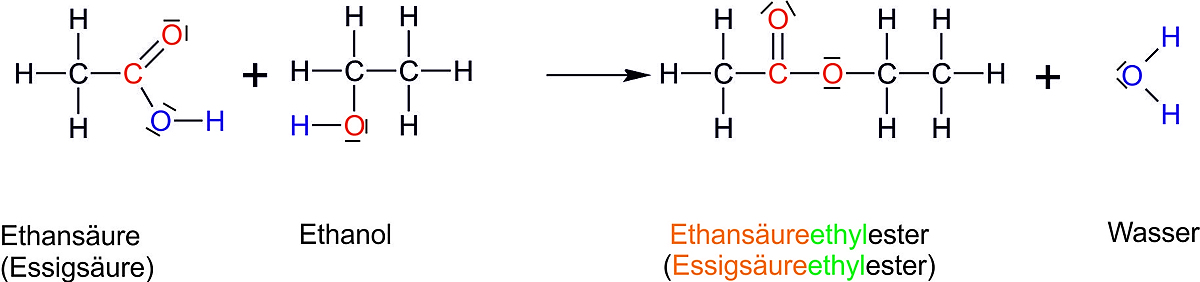
Bsp.: Estergleichgewicht (Ausgang: gleiche Konzentrationen von Alkohol und Carbonsäuren; vgl. Heftaufschrieb).
S A E W
Im GG: 1/3 mol 1/3 mol 2/3 mol 2/3 mol
Berechne Kc und bestimme, wo das Gleichgewicht liegt (links oder rechts):
{slider title="Lösung" open="false" class="icon"}
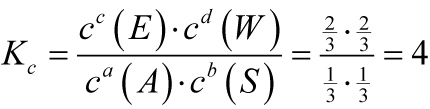
Das Estergleichgewicht liegt auf der rechten Seite.
{/sliders}
Merke:
Die Gleichgewichtskonstante KC ändert sich nur bei Temperaturänderung, jedoch nicht bei Konzentrationsänderung.
2.13.3 Änderung einer Gleichgewichtskonzentration eines Stoffes
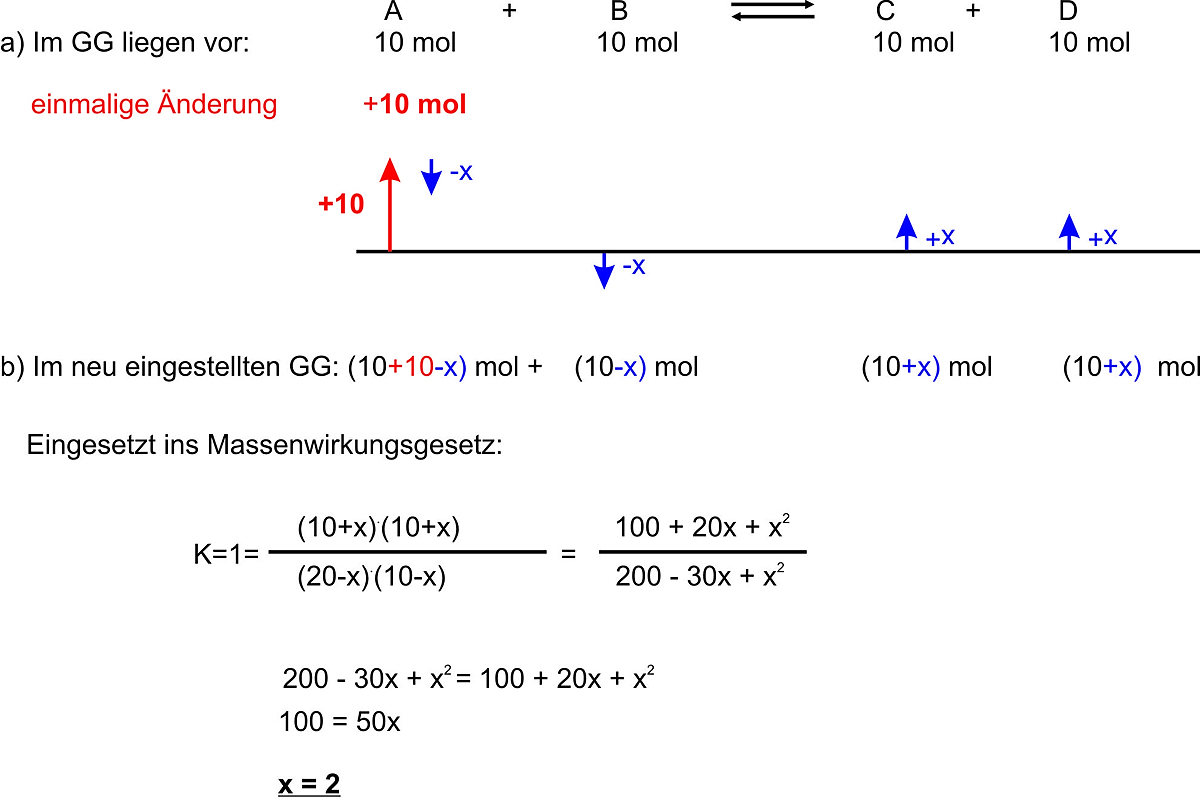
1. Beispiel (Kc=1)
Bei der Reaktion A + B <=> C + D liegen alle beteiligten Stoffe mit der Konzentration c = 10 mol/L vor. Bei einer einmaligen Änderung wird 10 mol vom Stoff A dazugegeben. Berechne die neu eingestellten Konzentrationen.
{slider title="Lösung" open="false" class="icon"}
Ergebnis: im neu eingestellten GG: A 18 mol; B 8 mol; C 12 mol; D 12 mol
Überprüfung:
![]()
{/sliders}
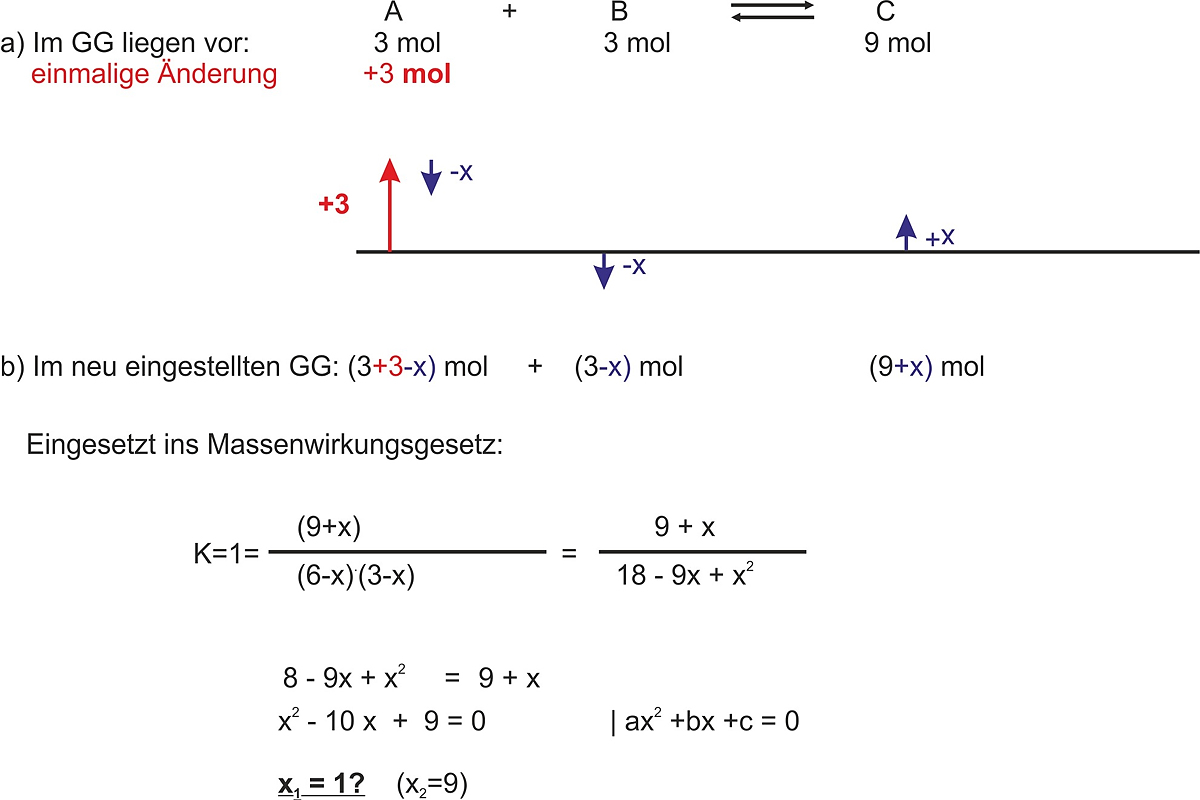
2. Beispiel (Kc=1)
Bei der Reaktion A + B <=> C liegen die Edukte jeweils mit 3 mol/l vor.
- Berechne die Konzentration von Stoff C
- als einmalige Änderung wird 3 mol vom Stoff A zugegeben. Berechne die neu eingestellten Konzentrationen
{slider title="Lösung" open="false" class="icon"}
Ergebnis: im neu eingestellten GG: A 5 mol; B 2 mol; C 10 mol
{/sliders}
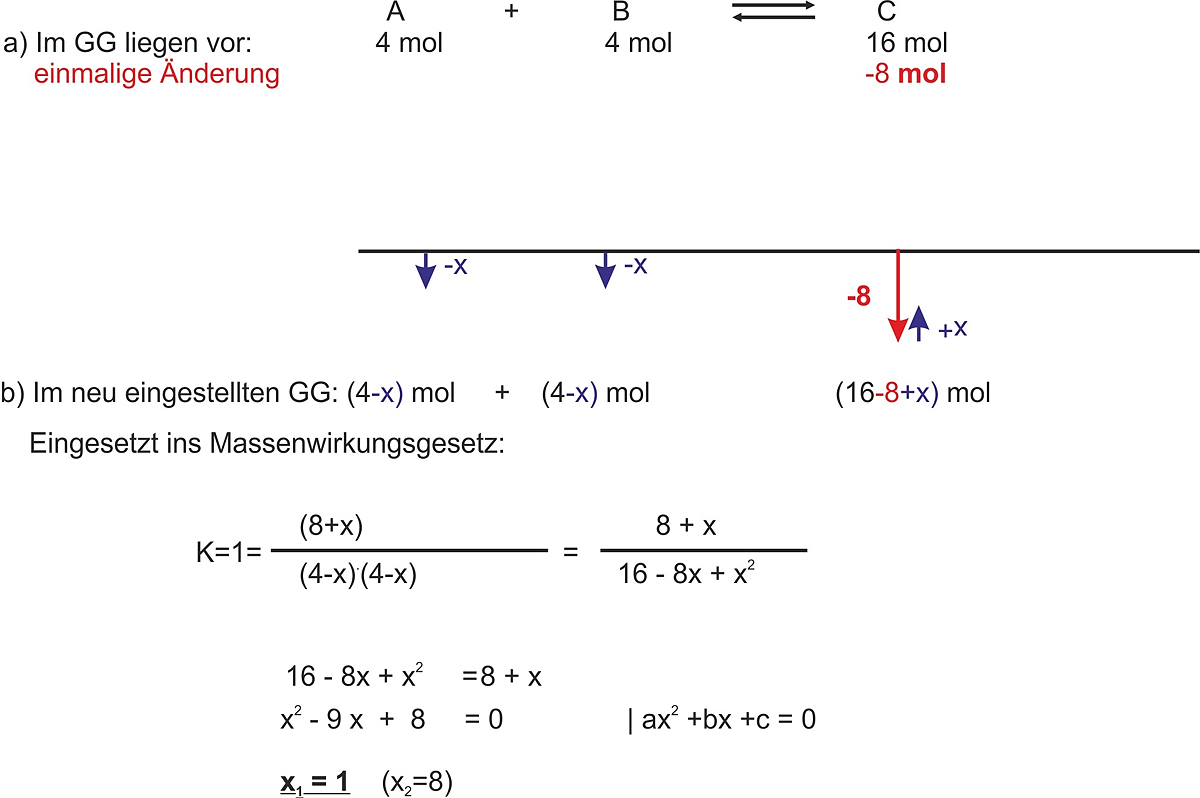
3. Beispiel
A + B <=> C
c(A) = 4 mol; c(B) = 4 mol; c(C) = 16 mol
- Berechne Kc
- als einmalige Änderung sollen 8 mol vom Stoff C entfernt werden. Berechne die neu eingestellten Konzentrationen.
{slider title="Lösung" open="false" class="icon"}
Ergebnis: im neu eingestellten GG: A 3 mol; B 3 mol; C 9 mol
Überprüfung![]()
{/sliders}