3.3 Zersetzungsspannung
Die Mindestspannung, bei der die Zersetzung des Elektrolyten beginnt, nennt man Zersetzungspannung.
vgl. AB
3.4 Überspannung
vgl. AB:
Bei der Elektrolyse läuft ein Gesamtvorgang ab, welcher die kleinste Zersetzungsspannung erfordert.
Die Differenz zwischen dem experimentell bestimmten und dem theoretisch zu erwartenden Abscheidungspotential bezeichnet man als Überspannung.
a) von der Art des Elektrodenmaterials;
b) von er Oberflächenbeschaffenheit des Elektrodenmaterials;
c) Art und Konzentration der abzuscheidenden Ionen
d) Stromdichte (= Stromstärke I dividiert durch Elektrodenoberfläche)
Überspannungen sind groß bei Elektrodenreaktionen, die zur Abscheidung von Gasen (H₂, O₂ und Cl₂) führen. Überspannungen sind klein bei Elektrodenreaktionen, die zur Abscheidung von Metallen führen.
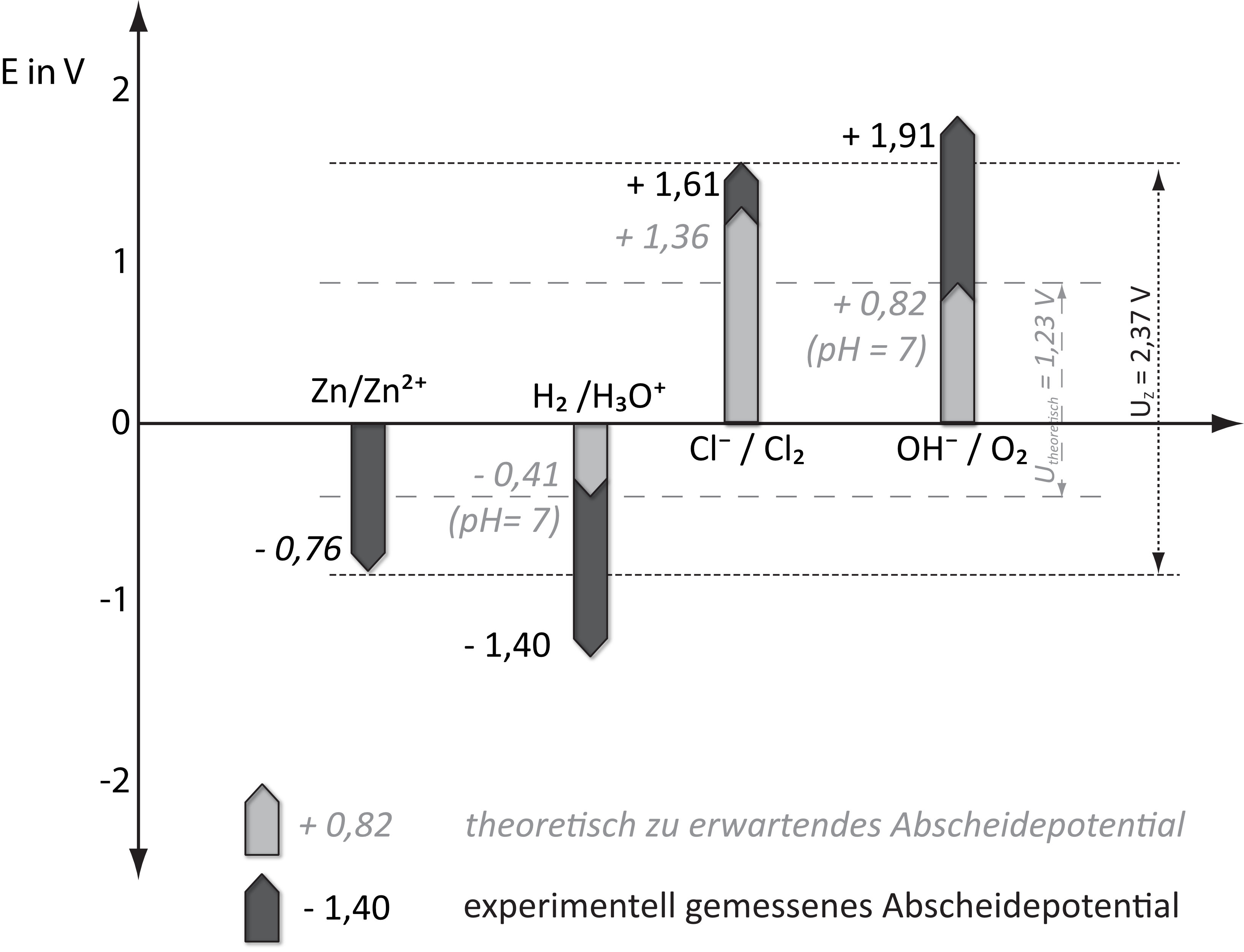
Beispiel: Betrachte folgendes Diagramm und gebe dann an, welche Stoffe
a) theoretisch ohne Berücksichtigung der Überspannung abgeschieden werden müsste und wie hoch deren Zersetzungsspannung sein müsste?
b) welche Stoffe sich im Experiment tatsächlich abscheiden und wie hoch deren Abscheidungspotentil ist.
{slider title="Lösung" open="false" class="icon"}
a) Abscheidung von Wasserstoff und Sauerstoff bei 1,23 V
b) Abscheidung von Zink und Chlor bei 2,37 V
{/sliders}
Abscheidungspotential
Berücksichtigt neben Elektrodenpotentiale noch die Überspannungsanteile (U*).
Es laufen diejenigen Reaktionen ab, die die kleinste Zersetzungsspannung erfordern:
Kathode: Stoff mit dem größten (positiveren) Abscheidungspotential reduziert (z.B. wird eher Fe²⁺ zu Fe reduziert (-0,41 V) als Li⁺ zu Li (-3,02 V).
Anode: Stoff mit dem kleinsten (negativeren) Abscheidungspotential wird oxidiert (z.B. wird eher Cu zu Cu²⁺ ( + 0,77 V) oxidiert als Au zu Au³⁺ ( + 1,42 V).