III. Quantitative Elementaranalyse
46g Ethanol ergeben bei der Verbrennung 88 g CO₂ und 54 g H₂O
- in 2 mol CO₂ sind 2 mol C (24g) enthalten
- in 3 mol H₂O sind 6 mol H (6g) enthalten
46 g Ethanol enthalten somit 2 mol C (24g) und 6 mol H (6g) und 1 mol (16g).
Atomzahlverhältnis im Ethanol: C : H : O = 2 : 6 : 1
Verhältnisformel: C₂H₆O₁
Molekülformel: C₂H₆O (Molekülmasse = 46u)
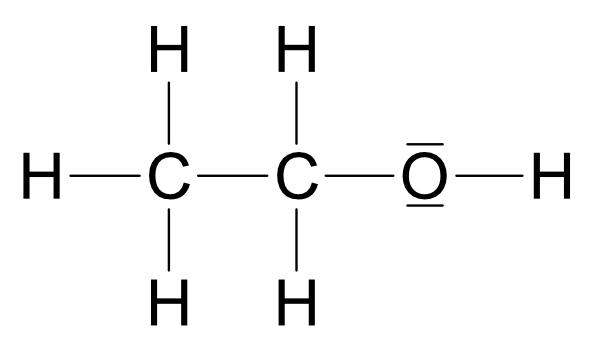
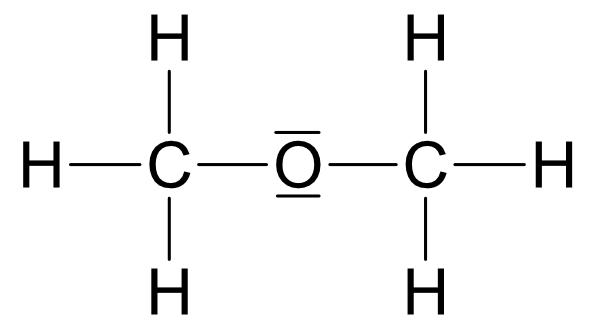
IV. Ermittlung der Strukturformel von C₂H₆O
Zwei Möglichkeiten:
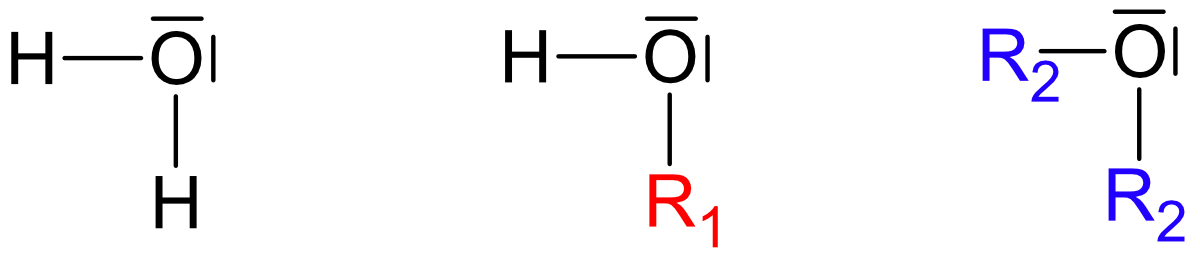
Wichtig: Ethanol und Dimethylether sind Derivate (Abkömmlinge) des Wassers.
Beide Strukturen leiten sich vom Wasser ab, jedoch ist Struktur a wasserähnlicher.
R1 = - C₂H₅ (Ethylrest)
R2 = - CH₃ (Methylrest)
Siedepunkt: Struktur a +78°C und Struktur b -25°C
Um herauszufinden, welche dieser Strukturen auf Ethanol zutrifft bitte nächste Seite anschauen.