2.2 Standardelektrodenpotential (Normalpotential)
2.2.1 Standardwasserstoffhalbzelle (Normalwasserstoffelektrode (NHE)
Da man nur Potentialunterschiede messen kann, wurde für Vergleichszwecke die Standardwasserstoffhalbzelle als Bezugssystem gewählt.
Das Potential der Standardwasserstoffhalbzelle wurde willkürlich null gesetzt.
Kombiniert man nun unter Standardbedingungen (25°C, Gasdruck 1013 hPa, Konzentration c = 1 mol/L) eine Metallhalbzelle bzw. Nichtmetallhalbzelle mit einer Standardwasserstoffhalbzelle, so bezeichnet man die gemessene Spannung als Standardelektrodenpotential bzw. Normalpotential des Metalls bzw. Nichtmetalls.
|
Ergänzung aus Wikipedia.de:
Chemie (IUPAC):
SATP-Bedingungen(Standard Ambient Temperature and Pressure) 298,15 K = 25 °C; 101.300 Pa = 1013 hPa |
2.2.2 Standardelektrodenpotential von Zink:
Versuch: Experimentelle Bestimmung des Normalpotentials von Zink:
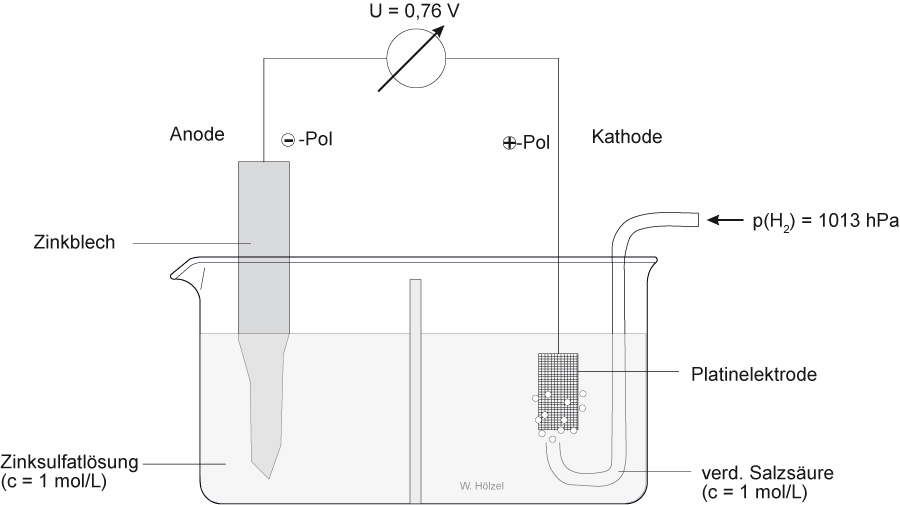
Elektrodenreaktionen (Halbzellenreaktionen)
Oxidation: - Pol: Zn → Zn²⁺(aq) + 2 e-
Reduktion : + Pol: 2 H₃O⁺(aq) + 2 e⁻ → H₂ + 2 H₂O
-------------------------------------------------------------------------------------------------------------
Gesamte Zellenreaktion: Zn(s) + 2 H₃O⁺(aq) → Zn²⁺(aq) + H₂(g) + 2 H₂O (l)
Zellendiagramm: Zn /Zn²⁺(c = 1 mol/L) // 2 H⁺(c = 1 mol/L) / [Pt]H₂
2.3 Festlegung für das Vorzeichen der Standardelektrodenpotentiale (Normalpotentiale)
Diejenigen Halbzellen („unedlere“ Halbzellen), die Elektronen an die NHE abgeben, bekommen ein negatives Standardelektrodenpotential.
Man kann sich dies leicht merken, wenn man daran denkt, dass Elektronen „von minus nach plus“ fließen.
Merke:
• Unedlere „Stoffe“ Standardelektrodenpotential negativ
• Wasserstoff Standardelektrodenpotential null
• Edlere „Stoffe“ Standardelektrodenpotential positiv
