4.4 Der räumliche Bau von Molekülen
{slider title="Link zur interaktiven Übungsseiten mit Bildern" open="false" class="icon"}
Etwas genauer, mit mehr Abbildungen gibt es auf der Basischemie-Seite. Zum Lernen vielleicht besser geeignet. Den Tafelanschrieb gibt es aber komprimierter auf dieser Seite.
Übungsseiten zum räumlichen Bau von Molekülen
{/sliders}
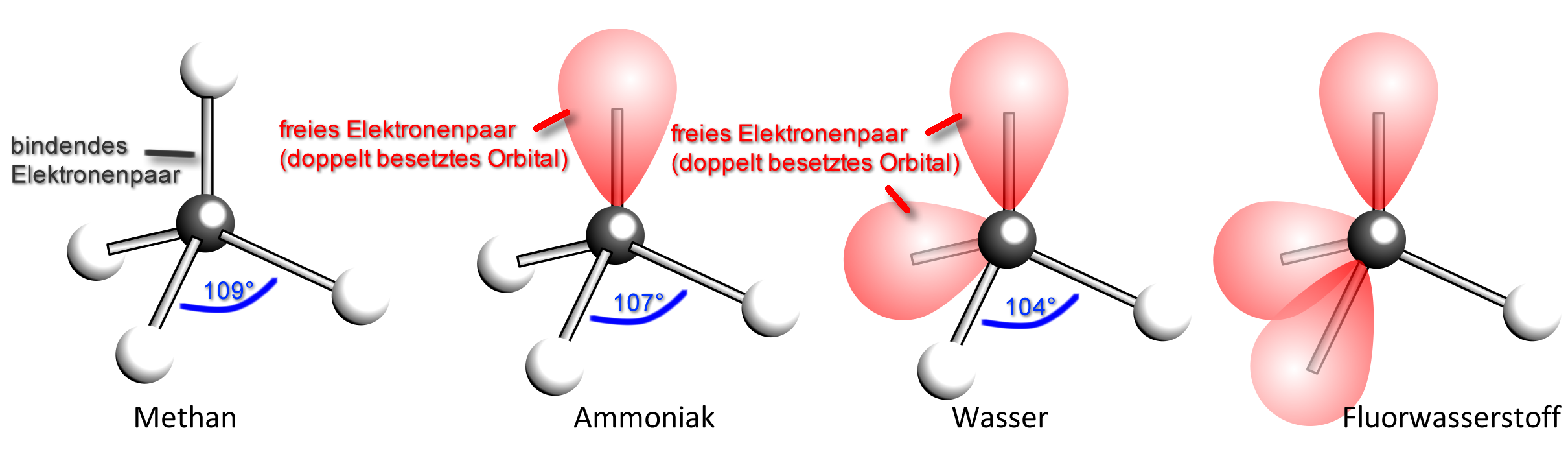
Im Kugelwolkenmodell ordnen sich die vier energetisch gleichwertigen Orbitale tetraedrisch an. Durch die gegenseitige Abstoßung (durch die gleiche, negative Ladung der Elektronen) der „Elektronenwolke“ erreichen sie so den größtmöglichen Abstand voneinander: Tetraederwinkel: 109,5 °
a) Das Methan-Molekül (CH₄)
Die 4 Wasserstoff-Atome sind tetraedrisch um das Kohlenstoff-Atom angeordnet. Die bindenden Elektronenpaare haben somit den größtmöglichen Abstand voneinander.
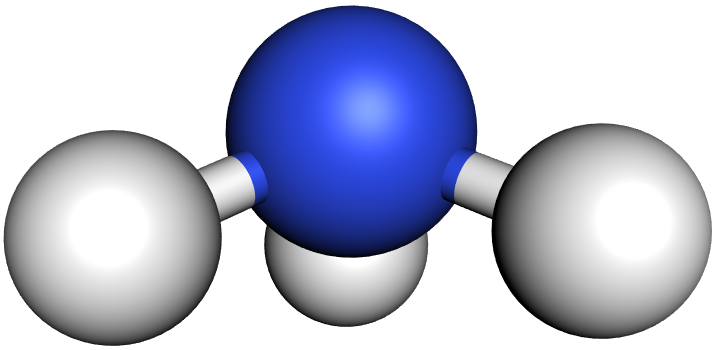
b) Das Ammoniak-Molekül (NH₃):
Im Ammoniak-Molekül stoßen sich die drei bindenden und das eine freie Elektronenpaar gegenseitig ab. Die Winkel zwischen den bindenden Elektronenpaaren sind jedoch nur 107° (statt 109,5°).
Erklärung (durch Zusatzannahmen): Die „Elektronenwolke“ eines nichtbindenden Elektronenpaares nimmt einen größeren Raumbereich ein als die eines Bindungselektronenpaars. Sie drückt daher die anderen „Elektronenwolken“ etwas näher zusammen. Der Bindungswinkel wird kleiner.
| Merke: Nichtbindende Elektronenpaare nehmen einen größeren Raum ein als bindende Elektronenpaare. |
Info für Interessierte: Das oben genanntes Modell ist ein vereinfachtes VSEPR-Modell (Abkürzung für englisch valence shell electron pair repulsion, deutsch Valenzschalen-Elektronenpaar-Abstoßung), auch EPA-Modell (Elektronenpaarabstoßungs-Modell)