2 Aromatische Kohlenwasserstoffe - Aromaten - Arene
“aromatisch” a. G. des süßlichen Geruchs vieler Naturstoffe.
Vorkommen i. d. Natur z.B.
Aminosäuren: Tyrosin, Typtophan, Phenylalanin
Nucleinbase Adenin
Lignin
weibliches Sexualhormon Estradiol (Ausbildung sek. Geschlechtsmerkmale)
2.1 Benzol - “Benzen”
a) Vorkommen
Steinkohlenteer, Erdöl
b) Eigenschaften
physikalische:
- farblose, klare Flüssigkeit (Smp.: 5°C; Sdp.: 80°C)
- geringere Dichte als Wasser
- in Wasser kaum, in Benzin in jedem Verhältnis löslich
- hohe Lichtbrechung
chemische:
- brennt mit stark rußender Flamme
- kein Nachweis von Doppelbindungen mit Brom möglich (Additionsreaktion)
- elektrophile Substitution mit Brom ist möglich
physiologische:
- starkes Gift
- carcinogen
c) Summenformel
C₆H₆
d) Strukturformel
August Kekulé (1866): Oszillationstheorie – schnelles „Umklappen“ der Doppelbindungen (nicht bestätigt).
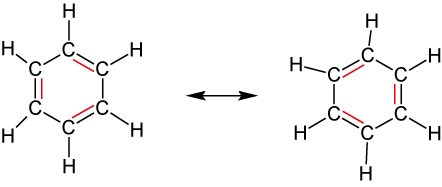
Heutiger Kenntnisstand:
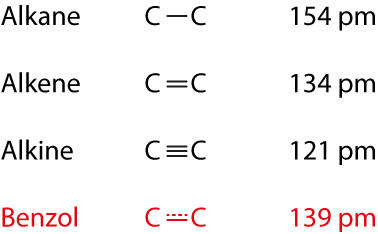
- ebenes gleichseitiges Sechseck
- Bindungsabstände:
- Bindungswinkel 120°
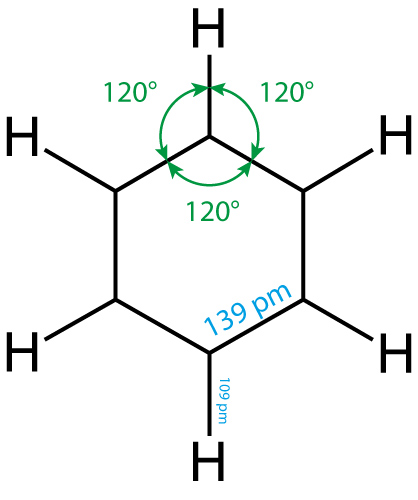
- Die je 6 Elektronen sind gleichmäßig über das ganze Sechseck verteilt = delokalisiert
⇨ Besonderer Bindungszustand!
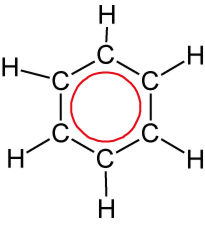 |
=  |
Energetischer Vergleich zwischen Benzol mit delokalisierten Elektronen und Kekulés Modell:
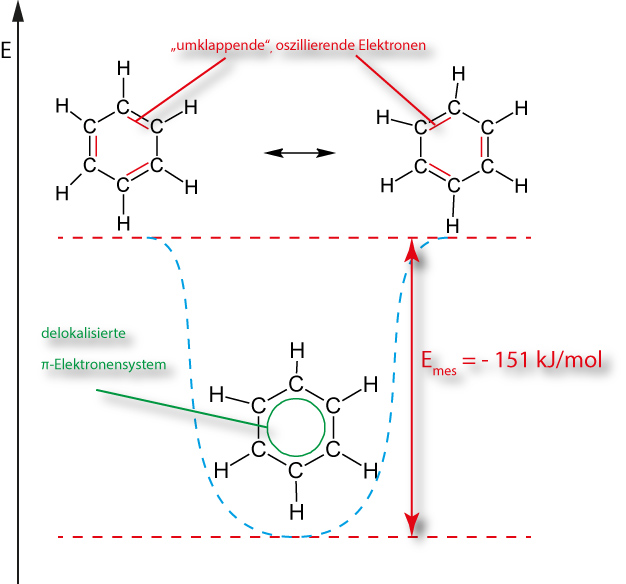
e) Vergleich von Cyclischen Kohlenwasserstoffe
⇨ vgl. AB
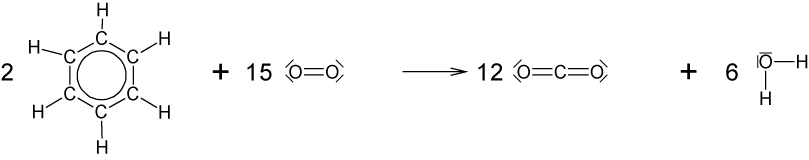
f) vollständige Verbrennung von Benzol