11.2 Die molare Standard-Entropie
Jede Substanz besitzt bei Standardbedingungen (25°C, 1013 hPa) eine bestimmte molare Standard-Entropie S° (Einheit: J/(K ∙ mol). Vergleicht man nur die S°-Werte einer Verbindung bzw. eines Elementes zwischen den verschiedenen Aggregatzuständen bzw. Lösungszuständen, so werden die obigen Faustregeln bestätigt.
| Formel | S° [J /(K ∙ mol) |
| I₂ (g) | 261 |
| I₂ (s) | 116 |
| H₂O (g) | 189 |
| H₂O (l) | 70 |
| NH₄Cl (aq) | 168 |
| NH₄Cl (s) | 95 |
Neben der Enthalpie ändert sich auch die Entropie eines Systems bei einer chemischen Reaktion.
Für die Berechnung der molaren Standard-Reaktionsenthalpie gilt:
| Stoff | H₂O (l) | H₂ (g) | O₂ (g) |
| S⁰ [J/(K ∙ mol)] | 70 | 131 | 205 |

Beispiel: 2 H₂ (g) + O₂ (g) → 2 H₂O (l)
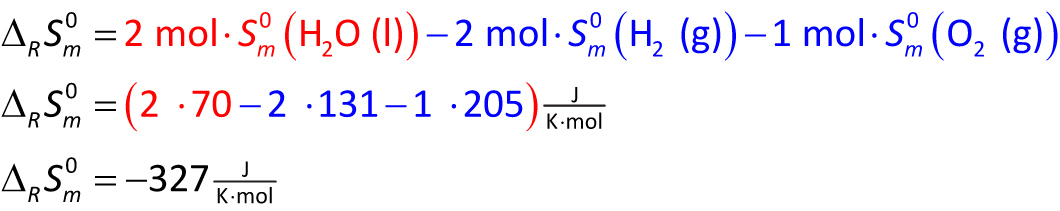
Es gilt:
ΔS < 0: Die Entropie nimmt ab !!
- ΔS > 0: Die Entropie nimmt zu.
Problem: Bildung von Wasser aus seinen Elementen ist eine spontane Aktion, wobei die Entropie des reagierenden Systems abnimmt.
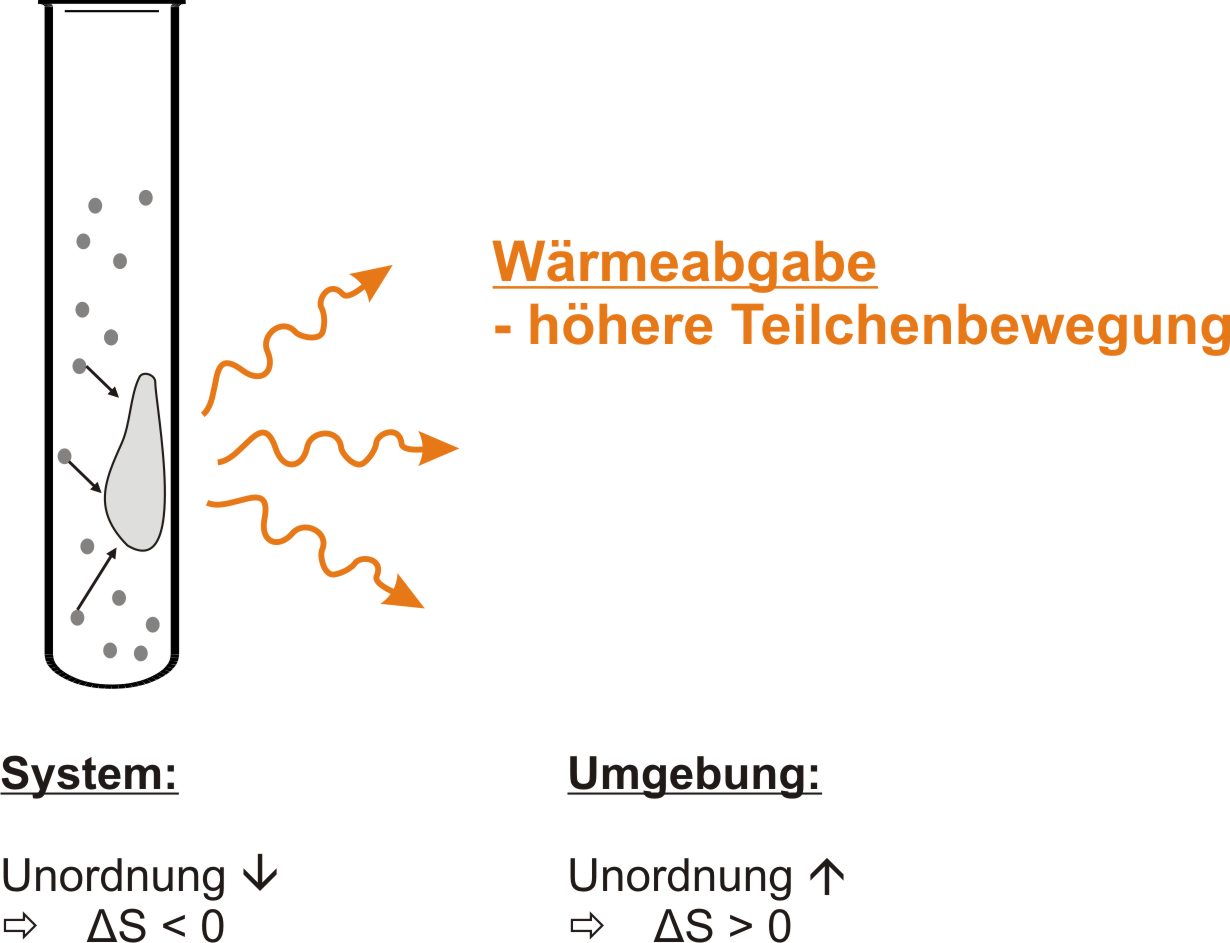
Bei einer spontanen Reaktion kann die Entropie jedoch nur zunehmen⇨ man muss alle Entropien berück-sichtigen: Entropie von System und Umgebung.
ΔrH° = - 572 kJ ⇨ Energie wird an Umgebung abgegeben ⇨ erhöht dort die Entropie:
ΔS°Umg = Q/T = - ΔrH°/T = 572 kJ/298K = 1919 J/K
ΔS°Ges = ΔrS° + ΔS°Umg = - 327 J/K + 1919 J/K = 1592 J/K
Bei spontanen Reaktionen nimmt die Gesamtentropie (= Systems und Umgebung) zu.
ΔS°Ges = ΔrS°Sys + ΔS°Umg > 0
Bsp.: Kondensation
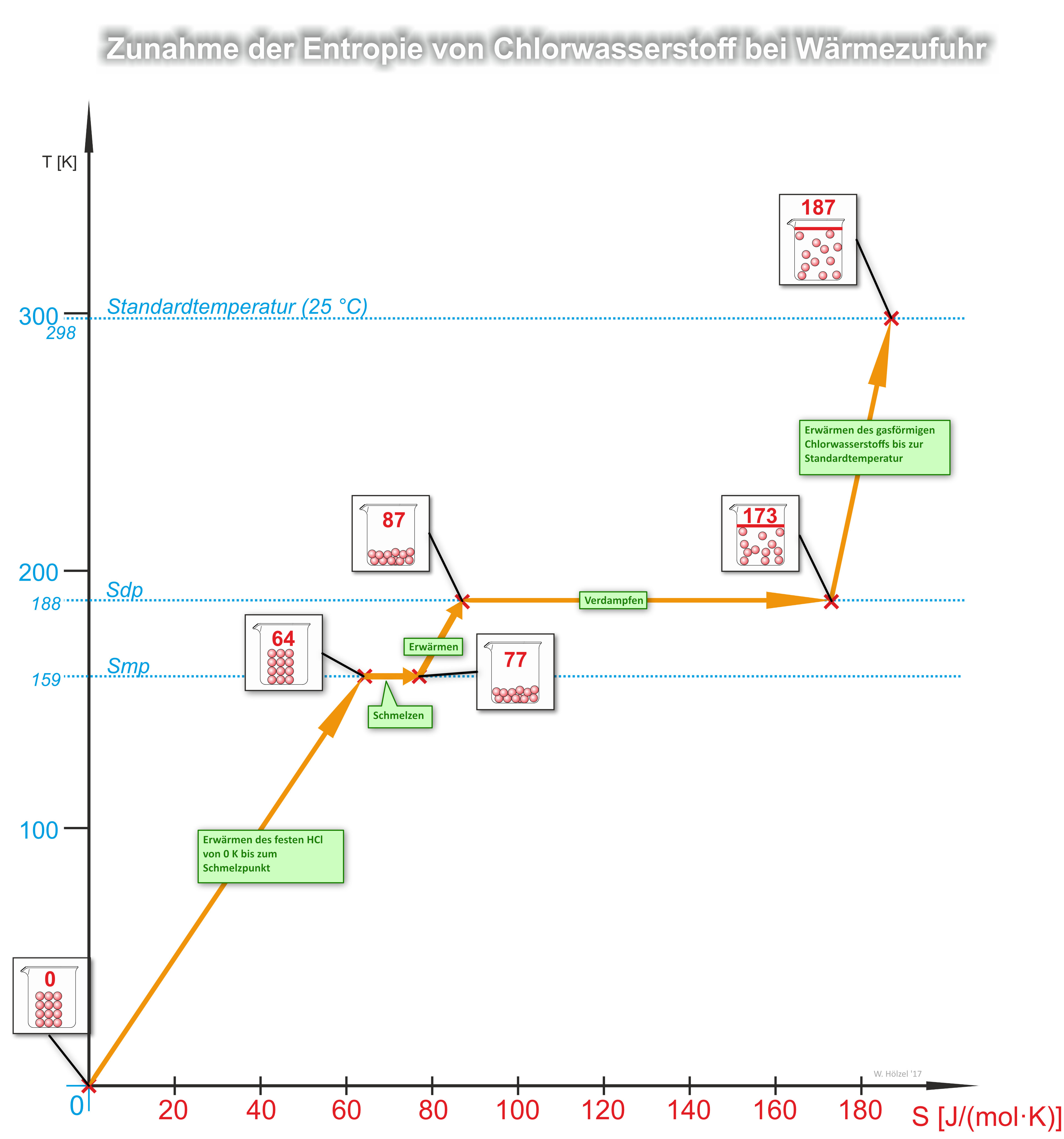
Weiteres Beispiel: Zunahme der Entropie von Chlorwasserstoff bei Wärmezufuhr