2.10 Verschiebung des Gleichgewichts
Die Lage des GG ergibt sich aus dem Zusammenwirken von Hinreaktion und Rückreaktion. Das GG verschiebt sich, wenn beide Reaktionen verschieden stark geändert werden.
Das ist häufig der Fall bei einer Änderung von
- Konzentration (Konzentration = Stoffmenge/Volumen)
- Temperatur
- Druck
2.10.1 Änderung der Konzentration und Temperatur
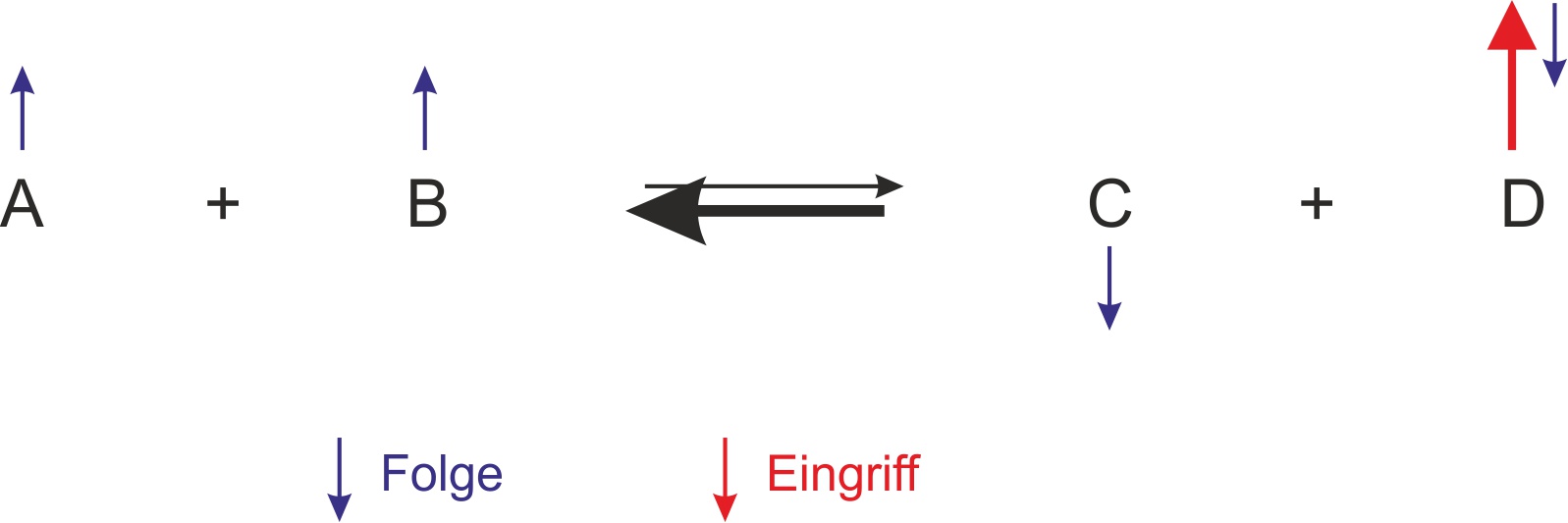
α) einmaliger Zusatz von Stoff D
Es erfolgen mehr Rückreaktionen (Wichtig, das über das Kollisionsmodell zu verstehen: durch mehr Teilchen wird häufiger ein Zusammenstoß zwischen C und D erfolgen); dadurch stellt sich ein neues Gleichgewicht ein. Man sagt: „Das GG wird nach links verschoben.“
Roter Pfeil: Zugabe von dem Stoff D -> Stoff D kollidiert häufiger mit C und reagieren miteinander. Dadurch werden es etwas weniger Stoffe C und D (blaue Pfeile auf der Produktseite); gleichzeit entstehen etwas mehr Stoffe A und B. Bitte immer dran denken, bei einem Gleichgewicht gibt es immer alle Stoffe; hier also gibt es gleichzeitig A, B, C und D!. Man kann sich das relativ schnell veranschaulichen, wenn man bei einer Reaktionsgleichung die Pfeile reinschreibt.
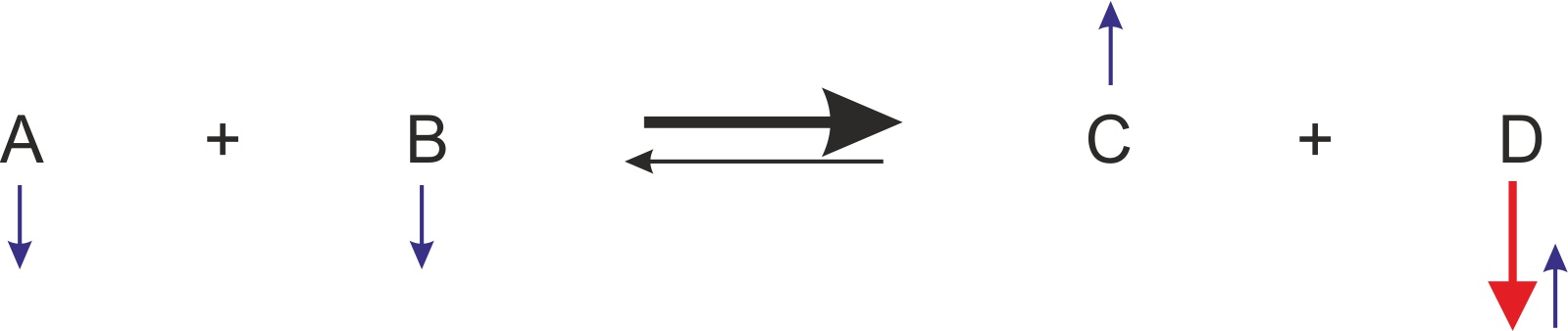
β) einmalige Wegnahme von Stoff D
Jetzt seid ihr dran. Wie ändert sich das GG, wenn man einmalig den Stoff D wegnimmt. Macht eine analoge Reaktionsgleichung mit Pfeilen wie oben.
{slider title="Lösung" open="false" class="icon"}
Es erfolgen mehr Hinreaktionen; dadurch stellt sich ein neues Gleichgewicht ein. Man sagt: „Das GG wird nach rechts verschoben.“
{/sliders}
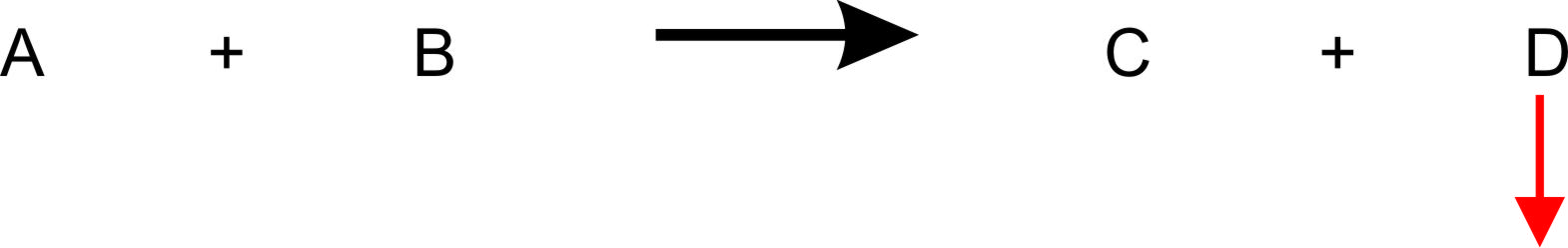
γ) dauernde Wegnahme von Stoff D (z.B. als Gas)
Wie ändert sich bei dauerhaften Wegnahme das GG, wenn der Stoff D, der entsteht, permanent aus dem System verdampft?
{slider title="Lösung" open="false" class="icon"}
In einem offenen System kann sich kein Gleichgewicht einstellen; Die Reaktion läuft vollständig ab.
{/sliders}
Eisenrhodanit-Gleichgewicht
Vergleich dazu Arbeitsblatt zum Experiment.
Vereinfachte Reaktionsgleichung:
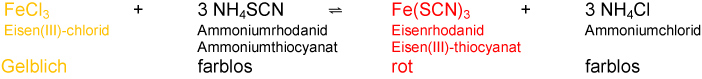
a) Das 1. RG bleibt unverändert und dient zum Vergleich!
b) Ein Spatellöffel NH4Cl (Ammoniumchlorid) wird in das Reagenzglas 2 gegeben.
Beobachtung: Die Lösung wird heller.
Wie kann man das mit Hilfe des Verschiebung des Gleichgewichts deuten?
{slider title="Lösung" open="false" class="icon"}
Deutung: Das GG wird nach links verschoben
{/sliders}
c) Ein Spatelspitze FeCl3 (Eisenchlorid) wird in das Reagenzglas 3 gegeben.
Nenne die mögliche Beobachtung und Deutung:
{slider title="Lösung" open="false" class="icon"}
Beobachtung: Die Lösung wird dunkelrot.
Deutung: Das GG wird nach rechts verschoben.
{/sliders}
d) Ein Spatellöffel NH4 SCN (Ammoniumrhodanid = Ammoniumthiocyanat) wird in das Reagenzglas 4 gegeben.
{slider title="Lösung" open="false" class="icon"}
Beobachtung: Die Lösung wird dunkelrot.
Deutung: Das GG wird nach rechts verschoben
{/sliders}
| Ergebnis: Konzentrationserhöhung eines Reaktionspartners begünstigt die Reaktion, die diesen Stoff verbraucht. |
e) Reagenzglas 5 wird in heißes Wasser gestellt.
Beobachtung: Die Lösung wird heller
{slider title="Lösung" open="false" class="icon"}
Deutung: Das GG wird nach links verschoben
{/sliders}
f) Reagenzglas 6 wird in Eiswasser gestellt
Überlegt, was jetzt die Beobachtung sein könnte:
{slider title="Lösung" open="false" class="icon"}
Beobachtung: Die Lösung wird dunkler.
Deutung: Das GG wird nach rechts verschoben
{/sliders}
| Ergebnis: • Temperaturerhöhung begünstigt die endotherme Reaktion; • Temperaturerniedrigung begünstigt die exotherme Reaktion. |
FeCl3 + 3 NH4SCN ⇌ Fe(SCN)3 + 3 NH4Cl ΔH<0
b) weitere Beispiele
H2O (l) ⇌ H2O (g) ΔH=+41 kJ
flüssig gasförmig
Temperaturerhöhung --> mehr Wasser verdampft.
2.10.2 Änderung des Drucks
a) Chlorethandampf - Chlorethanflüssigkeit (Kältespray); genau: Monochlorethan
C2H5Cl (g) ⇌ C2H5Cl (l)
α) Bei Druckerhöhung bilden sich im Kolbenprober Chlorethantröpfchen:
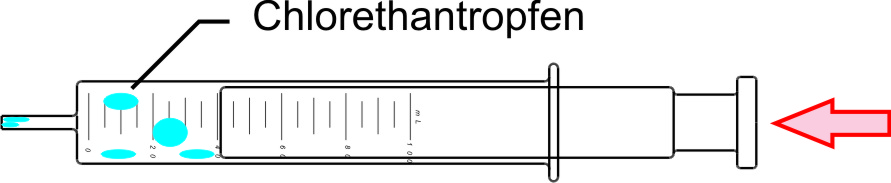
β) Bei Druckerniedrigung verschwinden diese Chlorethantröpfchen wieder.
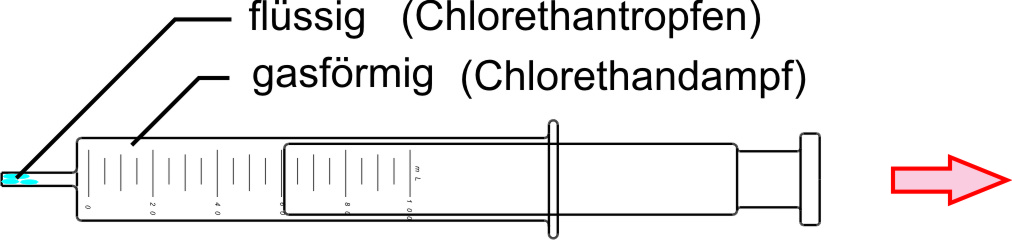
γ) Ergebnis:
• Druckerhöhung begünstigt die Reaktion mit Volumenabnahme.
b) weitere Beispiele
H₂O (s) ⇌ H₂O (l)
Fest (solid) flüssig (liquid)
Druckerhöhung verschiebt das Gleichgewicht nach rechts, Wasser wird flüssig.
Grund: flüssiges Wasser hat eine größere Dichte (kleineres Volumen) als Eis (Eis schwimmt).