4.5 Säure-Base-Reaktionen in Salzlösungen
Neutralisationsreaktion: Säure + Base ⇌ Salz + Wasser
⇨ die entstehende Lösung muss nicht unbedingt neutral sein.
4.5.1 Kationen als Säuren
a) Kationen als korresponiderende Säuren einer schwacher Basen.
Kation muss es ein Proton abgeben können:
NH₄⁺ + H₂O ⇌ NH₃ + H₃O⁺
schwache Base
b) Hydratisierte Metall-Kationen (Bsp. Fe³⁺(aq); Al³⁺(aq))
Bsp. [Fe(H₂O)₆]³⁺ + H₂O ⇌ [Fe(OH)(H₂O)₅]²⁺ + H₃O⁺
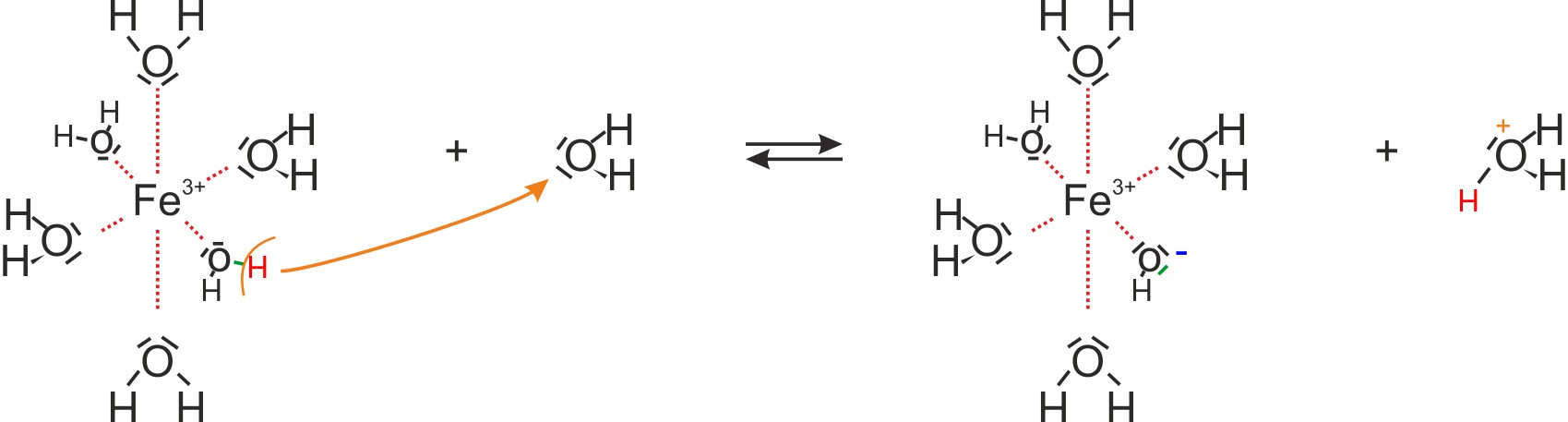
Bei mehrfach positiv geladene Metallionen werden die Wassermoleküle der Hydrathülle so stark polarisiert, dass es zur Abspaltung eines Protons kommen kann.
Umso stärker sauer, je....
- höher die Ladung
- kleiner der Radius des Metallkation ist
⇨ größer die Ladungsdichte ist
Alkali- und Erdalkalimetallkationen ⇨ geringe Ladungsdichte ⇨ geringe Säurestärke ⇨ vernachlässigbar
4.5.2 Anionen als Basen
a) Anionen als korrespondierendes Basen schwacher Säuren
Bsp. Natriumacetat
CH₃COO⁻ + H₂O ⇌ CH₃COOH + OH⁻
Acetat reagiert mit Wasser als Base
Hydratisierte Natrium-Ionen reagiert nicht mit Wasser
⇨ alkalische Lösung
b) Anionen sehr starker und vieler starker Säuren
schwache bis sehr schwache Basen ⇨ keine Säure-Base-Reaktionen
Bsp für „neutrale Anionen“ Cl⁻, Br¹⁻, I¹⁻, NO₃⁻, ClO₄⁻, SO₄²⁻
4.5.3 Hydrogensalze
Können sowohl als Säuren wie als Basen reagieren
Bsp.: HSO₄²⁻, H₂PO₄¹⁻ , HCO₃⁻
4.5.4 Neutrale Salzlösungen
- Möglichkeit: Kationen mit geringer Säurestärke + Anionen mit geringer Basenstärke (Bsp. NaCl)
- Möglichkeit: Säurestärke der einen Ionenart = Basenstärke der anderen Ionenart.
4.5.5 Abschätzung des pH-Wertes einer Salzlösung.
Abschätzung mit Hilfe der pKS- oder der pKB-Werte.
Bsp.:
Natriumhydrogensulfat: pKS (HSO₄⁻) = 1,92 ⇨ sauer
[Fe(H₂O)₆]³⁺ + 3 Cl⁻ pKS = 2,22 ⇨ sauer
Kaliumcarbonat pKB = 3,60 ⇨ basisch
Ammoniumacetat pKS (NH₄⁺) = pKB(Ac⁻) = 9,25 ⇨ neutral
4.5.6 Zusammenfassung (siehe Arbeitsblatt )
Regeln zur generellen Voraussage über den sauren oder basischen Charakter von Salz-Lösungen.
1. Salz von starken Basen mit starken Säuren ⇨ keine Beeinflussung des pH-Wertes. pH = 7
Bsp.: NaCl KNO₃ Ba(ClO₃)₂
2. Salz von starken Basen mit schwachen Säuren ⇨ basische Lösungen pH > 7
Bsp.: KNO₂ Ca(CH₃COO)₂ NaCN
3. Salze von schwachen Basen mit starken Säuren ⇨ saure Lösungen pH < 7
Bsp.: NH₄NO3 FeBr₂ AlCl₃
4. Salze von schwachen Basen mit schwachen Säuren ⇨ sauer oder basisch
Abhängig ob der saure Charakter oder der basische Charakter des Anions überwiegt.
Bsp.: NH₄CN Cu(NO₂)₂
Können sowohl als Säuren wie als Basen reagieren
