2.4 Bohr – Schalenmodell der Elektronenhülle
{slider title="Link zur Übungsseite" open="false" class="icon"}
Link zur Übungsseiten zum Bohrsschen Schalenmodell (mit vielen Abbildung)
{/sliders}
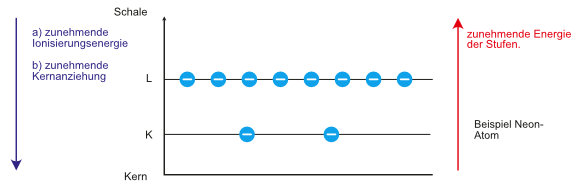
a) Ionisierungsenergien eines Neon-Atoms
Man hat herausgefunden, dass wohl nicht alle Elektronen "gleich" in der Hülle "verteilt" sind. Mit Hilfe von einem Experiment, in dem man nach und nach alle Elektronen von einem Neon-Atom entfernt kann man es nachweisen.
{slider title="Experiment mit Ergebnissen zur Ionisierung eines Neon-Atoms" open="false" class="icon"}
Ionisierungsenergien eines Neon-Atoms [MJ/mol], also die Energie, die man benötigt um das Elektron zu entfernen. Durchnummeriert vom 1. Elektron bis zum 10. Elektron:
- e⁻ = 2,1 MJ/mol
- e⁻ = 3,9 MJ/mol
- e⁻ = 6,2 MJ/mol
- e⁻ = 9,4 MJ/mol
- e⁻ = 12,2 MJ/mol
- e⁻ = 15,2 MJ/mol
- e⁻ = 20,0MJ/mol
- e⁻ = 23,0 MJ/mol
- e⁻ = 115,0 MJ/mol
- e⁻ = 130,0 MJ/mol
Beobachtung: Man benötigt immer mehr Energie, um das erste, zweite, dritte und die folgenden Elektronen vollständig abzutrennen.
Folgerung: Der verbleibende „Rumpf“ wird immer positiver und damit erfordert die Abrennung der folgenden Elektronen immer größere Energie.
Beobachtung: Man benötigt zur Abspaltung der beiden letzten Elektronen (z.B. im Vergleich zum drittletzten Elektron) besonders viel Energie.
Folgerung: Die Elektronen des Neons lassen sich in zwei Gruppen einteilen.
- Die zwei Elektronen mit großer Ionisierungsenergie sind im zeitlichen Mittel näher am Kern.
- Die acht Elektronen mit relativ kleinen Ionisierungsenergien sind im zeitlichen Mittel weiter vom Kern entfernt.
{/sliders}
b. Energiestufenschema (Neon-Atom)
Ein Neon-Atom könnte man mit der Elektronenverteilung wie folgt aufschreiben:
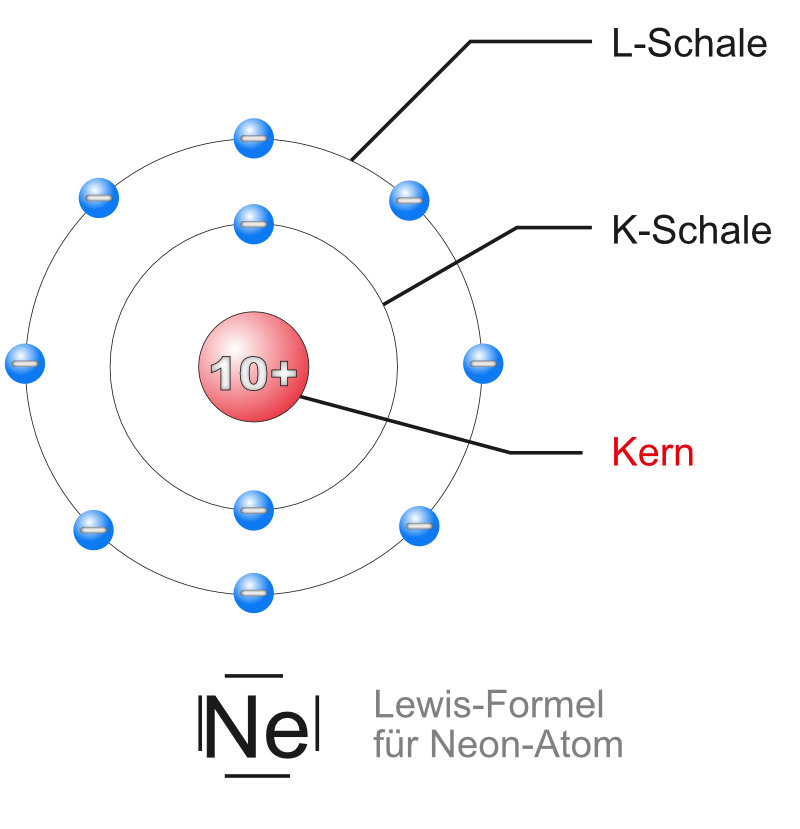
c. Schalenmodell (Neon-Atoms)
Die Energiestufen lassen sich als konzentrischen Kugelschalen um den Kern veranschaulichen. Man erhält damit ein „Schalenmodell“ des Neonatoms (mit Lewis-Formel). Hinweis: Der Kern ist zusammengefasst. Eigentlich müsste man dort 10 Protonen und 10 Neutronen zeichnen, aber das macht die Sache nicht anschaulicher. Deshalb nur ein "Kern" mit der Ladung.
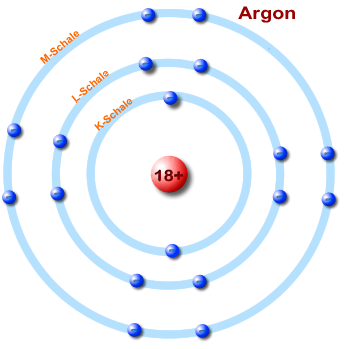
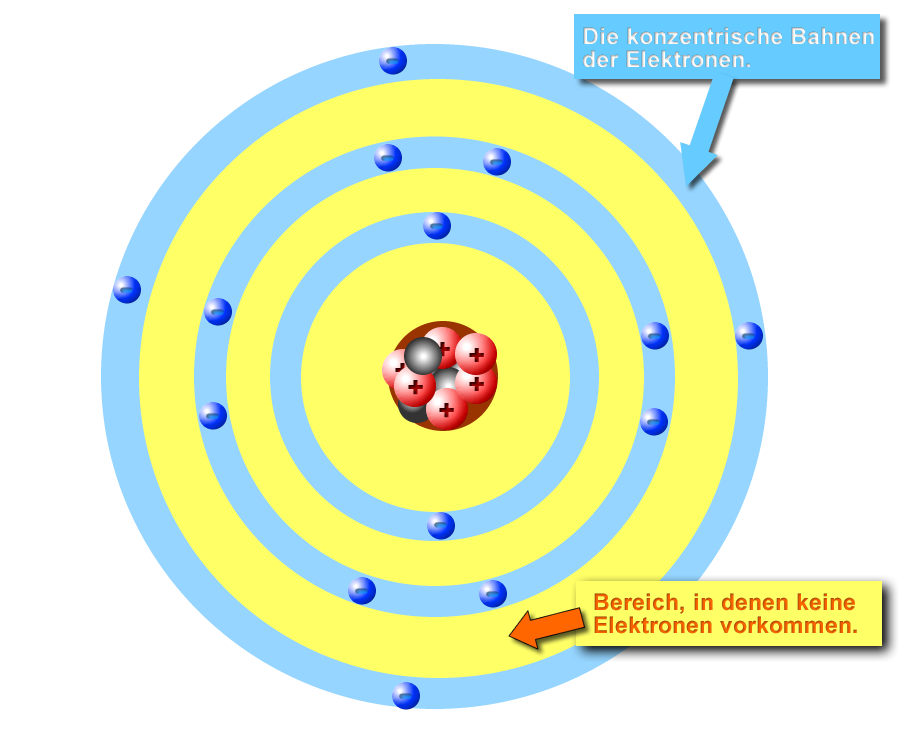
Die Elektronen sind verteilt "auf" den Schalen dargestellt, die kugelförmig den Bereich der Elektronen angeben. In der inneren Schale sind es zwei Elektronen in der äußeren Schale acht.
Weitere Beispiele (Abbildungen aus der interaktiven Seite; ausführlichere Erklärungen siehe dort).
Schalenmodell eines Aluminium-Atoms
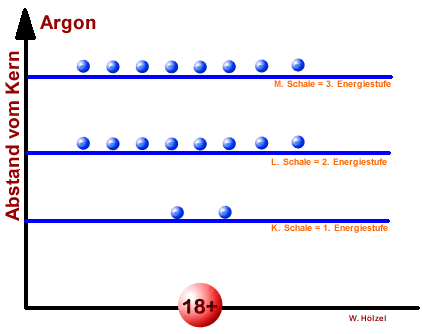
Vergleich - Energiestufen vers. Schalenmodell eines Argon-Atoms
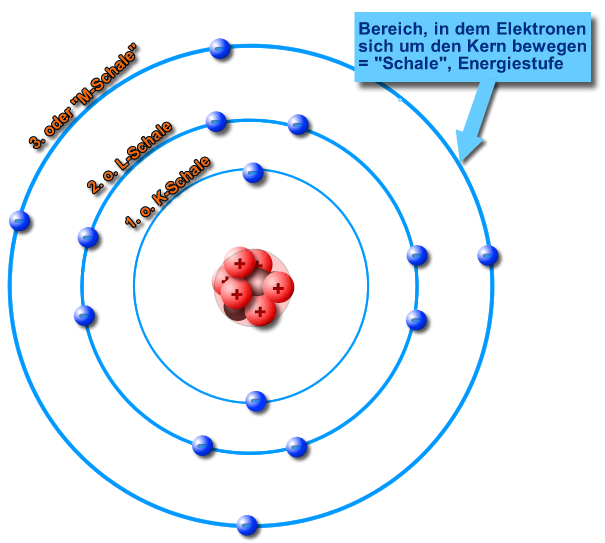
Atomschalen
d) Postulate (= Grundannahmen) von Niels Bohr:
1. Die Elektronen bewegen sich nur auf ganz bestimmten, genau definierten Bahnen (= Energiestufen, Energieschalen, Schalen) um den Atomkern. Die Elektronen bewegen sich nicht zwischen dieser Energiestufen.
2. Jede Schale kann maximal 2 n² Elektronen aufnehmen
n = Schalennummer
n = 1, 2, 3, 4, ...
K, L, M, N, ... Schale
3. Für jede Bahn, auf der das Elektron den Atomkern umkreist, hat das Elektron eine bestimmte Energie. Auf der K-Schale (n = 1), die dem Atomkern am nächsten ist, kommt dem Elektron die geringste Energie zu.