3.5 Stärke von Säuren und Basen
Brønsted-Theorie:
Säurestärke ist die Tendenz Protonen abzugeben.
Basenstärke Tendenz Protonen aufzunehmen.
Bsp. HCl + H₂O → H₃O⁺ + Cl⁻
Säure 1 Base 2 Säure 2 Base 1
Info: Supersäuren = Säuren die stärker als H₂SO₄ sind.
Je stärker die Säure desto schwächer die konjugierte (korrespondierende) Base.
3.5.1 Säurestärke und Molekülstruktur
A) Säuren, an denen H-Atome nicht an O-Atome gebunden sind.
Faktoren für Säurestärke von Bedeutung:
- Elektronegativität (innerhalb einer Periode)
- Atomgröße (innerhalb einer Gruppe)
a) innerhalb einer Periode (binäre H-Verbindungen)
Säurestärke nimmt mit der EN zu (Atomgrößenunterschiede sind „zu“ gering)
⇨ Elektronen werden stärker dem H-Atom entzogen ⇨ erleichterte Protonenabspaltung.
Bsp.:
2. Periode:
Zunahme der EN: N < O < F
Zunahme der Säurestärke NH₃ < H₂O < HF
Gegenüber Wasser Base Säure
3. Periode
Zunahme der EN: P < S < Cl
Zunahme der Säurestärke PH₃ < H₂S < HCl
b) innerhalb einer Gruppe (binäre H-Verbindungen):
Säurestärke nimmt mit der Atomgröße zu (stärkere Auswirkung als Elektronegativität)
⇨ bei einem großen Atom ist die Valenzelektronenwolke auf einem größeren Raum verteilt ⇨ H⁺ ist weniger fest gebunden.
H₂O < H₂S < H₂Se < H₂Te
HF < HCl < HBr < HI
B) Oxosäuren
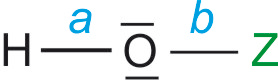
Sauerstoff hat in etwa die gleiche Größe
a) EN von Z ist entscheidend.
Je größer die EN von Z, desto stärker ist die Säure (-I-Effekt).
HOI < HOBr < HOCl
hyopoiodige Säure hypobromige hypochlorige Säure
b) An Z sind weitere O-Atome gebunden ⇨ stärkerer –I-Effekt (bzw. höhere Formalladung am Z. )
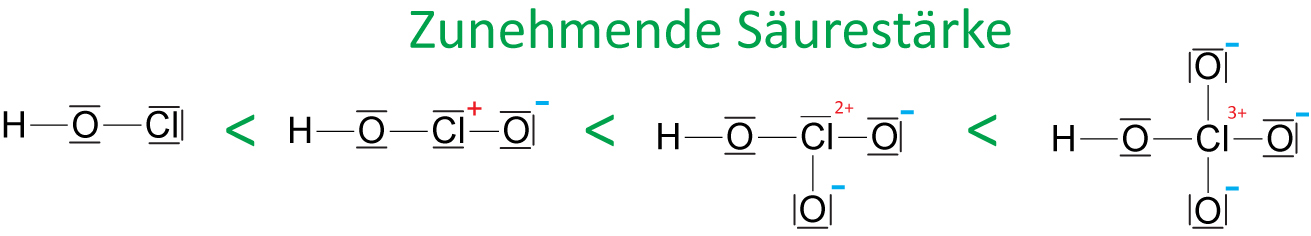
hypochlorige – chlorige – Chlor – Perchlorsäuren
⇨ Man kann Säurestärke abschätzen: Je mehr mehr O-Atome an das Z-Atom jedoch nicht an H-Atom gebunden sind, desto die Säure:
H-O-NO < H-O-NO₂
salpetrige Säure Salpetersäure
(H-O-)₂SO < (H-O-)₂SO₂
schweflige Säure Schwefelsäure
c) Mehrprotonige Säuren:
Für jede Dissoziationsstufe liegt eine eigene Säurekonstante bzw. pKs-Wert vor:
H₃PO4 + H₂O ⇌ H₂PO₄¹⁻ + H₃O⁺ KS = 7,4∙ 10⁻³, pkS = 2,13
Phosphorsäure Dihydrogenphosphation
H₂PO₄¹⁻ + H₂O ⇌ HPO₄²⁻ + H₃O⁺ KS = 6,3∙10⁻⁸, pkS = 7,20
Hydrogenphosphation
HPO₄²⁻ + H₂O ⇌ PO₃³⁻ + H₃O⁺ KS = 7,4∙10⁻¹³, pkS = 12,36
Phosphation
d) Mesomerer Effekt
- +M-Effekt (Mesomerer-Effekt) der Anionen:
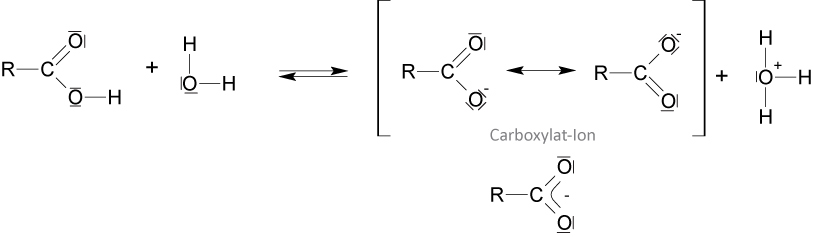
Eine Säure ist umso stärker, je....
... stabiler das gebildete Anion ⇨ Hydratation, Mesomeriestabilisiert.
... instabiler das Säuremolekül an der H-Bindung
3.6 Vergleich Säurestärke von Salzsäure und Essigsäure
Versuch: pH-Wert-Messung von
a) Salzsäure (c = 0,1 mol/L) Beob.: pH = 1
b) Essigsäure (c = 0,1 mol/L) pH = 2,9
Erklärung:
a) Salzsäure
HCl (aq) + H₂O (l) ⇌ H₃O⁺ (aq) + Cl⁻ (aq)
Vollständig protolysiert (GG ganz rechts)
b) Essigsäure
HAc (l) + H₂O (l) ⇌ H₃O⁺ (aq) + Ac- (aq)
Aus.: 0,1 mol/L
GG 0,099 mol/L 10⁻²,⁹ ∙1,6 ∙ 10⁻³
⇨ GG liegt links, nur jedes 100. HAc-Molekül protolysiert.
