4.2 Basestärke: der pKB-Wert
Als Maß für die Stärke einer Base dient das Ausmaß ihrer Reaktion mit Wasser:
Allgemeines Beispiel:
A¹⁻ + H₂O ⇌ HA + OH⁻
![]()
KB ist die Base(n)konstante. Auch hier gibt man meist den negativen dekadischen Logarithmus (negative Hochzahl) an:
pKB = - log KB
Es gilt: ![]()
4.3 Beziehung zwischen KS und KB eines korrespondierenden Säure-Base-Paares
HA ist eine beliebige Säure und A¹⁻ ihre konjugierte (korrespondierende) Base.
HA + H₂O ⇌ A¹⁻ + H₃O⁺ H₂O + A¹⁻ ⇌ OH⁻ + HA
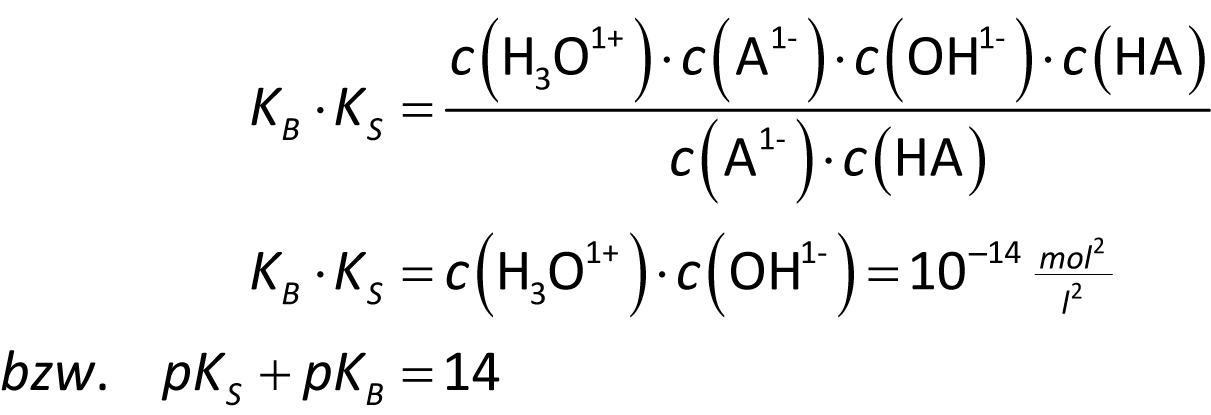
Merke: Ist der pKS – Wert einer Säure bekannt (Tabelle), so kann man mit obiger Gleichung den pKB-Wert berechnen (und umgekehrt).
Die obige Gleichung zeigt auch: Je stärker eine Säure ist, um so schwächer ist ihre korrespondierende Base (und umgekehrt).
Bsp.: Oxonium-Ion: KS = 55 pKS = - 1,74 (sehr starke Säure)
Wasser: pKB = 15,74 (sehr schwache Base)
