1 Das Periodensystem der Elemente (Teil I)
2 Atommodelle
2.1 Demokrit
2.2 Dalton: Kugelmodell
2.3 Rutherford: Kern-Hülle-Modell
2.3.1 Der Atomkern
2.4 Bohr – Schalenmodell der Elektronenhülle
2.5 Das Kugelwolkenmodell, KWM
2.5.1 Feinstruktur der Elektronenhülle
2.6 Das Periodensystem der Elemente (PSE) und die Atommodelle
2.7 Lewis – Formeln für Moleküle
3 Edelgasregel
4 Atombindung = Elektronenpaarbindung
4.1 Der räumliche Bau von Molekülen
4.2 Atomradien
4.3 Elektronegativität
4.4 Polare und unpolare Atombindung
4.5 Elektrische Dipole
5 Ionenbindung
5.1 Bindungsart und Elektronegativität
6 Spaltung einer Atombindung (Elektronenpaarbindung)
7 Zwischenmolekulare Bindungen/Kräfte (ZMK) – Intermolekularen Anziehungskräfte
7.1 Dipol-Dipol-Wechselwirkungen
7.2 Van-der-Waals-Kräfte (Van-der-Waals-Bindung; vdW-Kräfte)
7.3 Wasserstoffbrücken; Wasserstoffbrückenbindung
7.4 Zusammenfassung
8 Hydration, Hydratation (allgemein Solvatation)
8.1 Lösungsenthalpie
- Details
- Geschrieben von: Wolfram Hölzel
Im folgenden befindet sich hier der Tafelanschrieb für Klassenstufe 8 oder 9 mit dem Thema PSE - Atombau - Molekül-/Ionenbindung und Zwischenmolekulare Bindungen
Begleitet wird dieses Kapitel durch eine interaktive (technische vielleicht etwas veraltete) Seiten. In den Kapiteln wird auf konkrete Seiten verlinkt, diese können aber auch für sich gesehen werden.
Einleitung und Erklärung der interaktiven Seite
1 Das Periodensystem der Elemente (Teil I)
Ein Periodensystem kann von dieser Seite heruntergeladen werden: Beispiele von Periodensystemen (PSE)
Ordnungsprinzipien
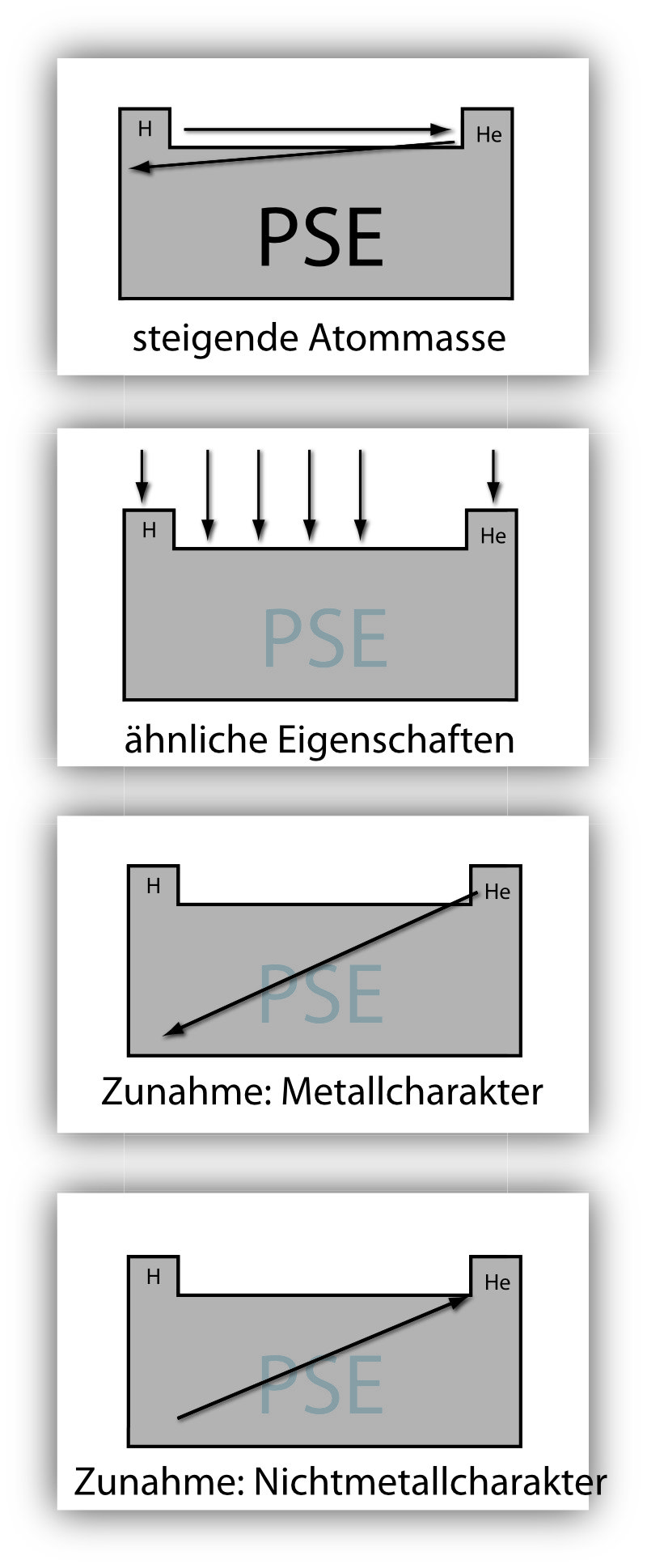
Ursprünglich nach steigender Atommasse geordnet, dann nach der Ordnungszahl und nach periodisch wiederkehrenden Ähnlichkeiten in den Eigenschaften.
Das Kurzperiodensystem enthält nur die Hauptgruppenelemente.
Die Hauptgruppen des PSE
I. Hauptgruppe: Alkalimetalle
II. Hauptgruppe: Erdalkalimetalle
III. Hauptgruppe: Borgruppe
IV. Hauptgruppe: Kohlenstoffgruppe
V. Hauptgruppe: Stickstoffgruppe
VI. Hauptgruppe: Chalkogene (Erzbildner)
VII. Hauptgruppe: Halogene (Salzbildner)
VIII. Hauptgruppe: Edelgase
Aussage
- Anordnung nach steigender Atommasse (Ausnahmen: K – Ar; Co – Ni; Te – J; Th – Pa).
- In jeder Hauptgruppe stehen verwandte Elemente.
- Metallischer Charakter nimmt nach links unten zu!
- Nichtmetallischer Charakter nimmt nach rechts oben zu!
- Halbmetalle stehen diagonal dazwischen.
Bedeutung
- Voraussage damals unbekannter Elemente (z. B. Germanium).
- Ablesen von physikalischen und chemischen Eigenschaften aus der Stellung im PSE.
- Details
- Geschrieben von: Wolfram Hölzel
2 Atommodelle:
Wiederholung aus der 8. Klasse:
2.1 Demokrit:
Atome sind die kleinsten, unteilbare Einheiten
2.2 Dalton: Kugelteilchenmodell
- Atome = unveränderlich, unsichtbar und unzerstörbar
- Atome eines Elementes sind untereinander gleich
- Sie unterscheiden sich von den Atomen anderer Elemente in ihrer Masse
- Bei chemischen Reaktionen werden Atome nicht verändert, sondern miteinander verknüpft oder getrennt.
- Details
- Geschrieben von: Wolfram Hölzel
2.3 Rutherford: Kern-Hülle-Modell
Atome bestehen aus:
- sehr kleinen, positiv geladenen Kern
- negative kugelförmige Elektronenhülle
- die Elektronen bewegen sich mit hoher Geschwindigkeit um den Kern.
Ein Atommodell, das zwischen Atomkern und Elektronenhülle unterscheidet, wird als Kern-Hülle-Modell bezeichnet.
Die Teilchen, aus denen ein Atom besteht, bezeichnet man als Elementarteilchen (Protonen, Neutronen und Elektronen).
{slider title="Link zur Übungsseite" open="false" class="icon"}
⇒ Interaktive Übungsseiten zu Elementarteilchen und deren Anziehung oder Abstoßung.
{/sliders}
2.3.1 Der Atomkern
{slider title="Link zur Übungsseite" open="false" class="icon"}
⇒ Interaktive Übungsseiten zum Atomkern und Atomhülle
{/sliders}
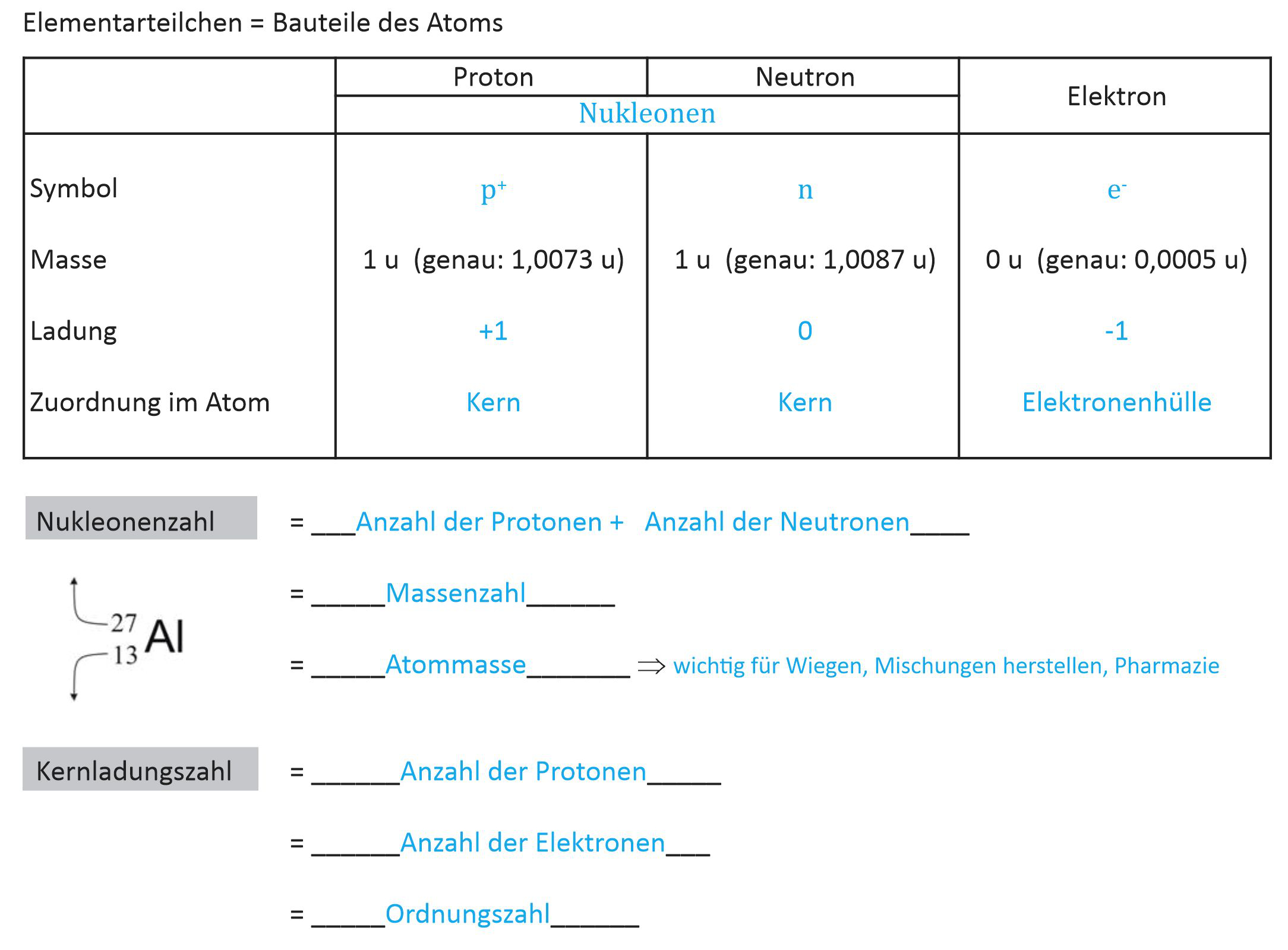
- Der Atomkern ist aus Protonen und Neutronen aufgebaut.
- Die Protonenzahl stimmt mit der Ordnungszahl eines Elements und der Kernladungszahl überein.
Bsp.: Fluor = ₉F: 9 Protonen: Ordnungszahl und Kernladungszahl = 9, Elektronenanzahl = 9. - Nukleonenzahl: Anzahl der Protonen + Anzahl der Neutronen im Atomkern.
Bsp: Die Nukleonenzahl von Fluor ¹⁹F ist 19 ⇒ 9 Protonen und 10 Neutronen - Massenzahl
Die Atommasse ist angenähert die Summe der Protonen- und Neutronenmasse. Die Masse der Elektronen ist außerordentlich klein. - Schreibweise
Na, alles verstanden? Hier gibt es einen Ausschnitt eines Übungsarbeitsblattes. Hinter dem Slider ist dann die Lösung:
{slider title="Lösung" open="false" class="icon"}
{/sliders}
- Details
- Geschrieben von: Wolfram Hölzel
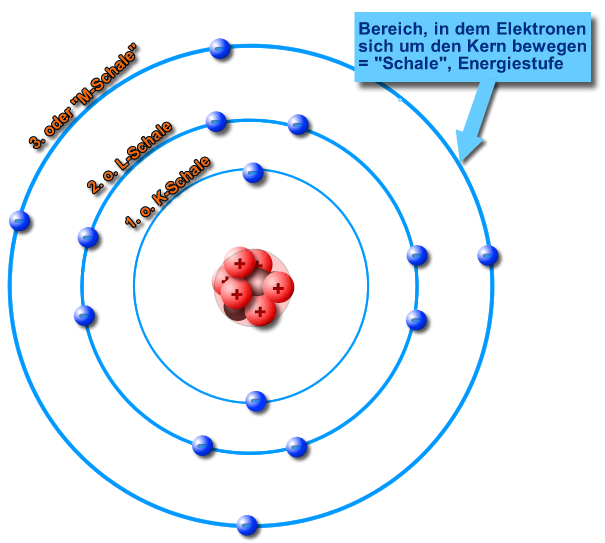
2.4 Bohr – Schalenmodell der Elektronenhülle
{slider title="Link zur Übungsseite" open="false" class="icon"}
Link zur Übungsseiten zum Bohrsschen Schalenmodell (mit vielen Abbildung)
{/sliders}
a) Ionisierungsenergien eines Neon-Atoms
Man hat herausgefunden, dass wohl nicht alle Elektronen "gleich" in der Hülle "verteilt" sind. Mit Hilfe von einem Experiment, in dem man nach und nach alle Elektronen von einem Neon-Atom entfernt kann man es nachweisen.
{slider title="Experiment mit Ergebnissen zur Ionisierung eines Neon-Atoms" open="false" class="icon"}
Ionisierungsenergien eines Neon-Atoms [MJ/mol], also die Energie, die man benötigt um das Elektron zu entfernen. Durchnummeriert vom 1. Elektron bis zum 10. Elektron:
- e⁻ = 2,1 MJ/mol
- e⁻ = 3,9 MJ/mol
- e⁻ = 6,2 MJ/mol
- e⁻ = 9,4 MJ/mol
- e⁻ = 12,2 MJ/mol
- e⁻ = 15,2 MJ/mol
- e⁻ = 20,0MJ/mol
- e⁻ = 23,0 MJ/mol
- e⁻ = 115,0 MJ/mol
- e⁻ = 130,0 MJ/mol
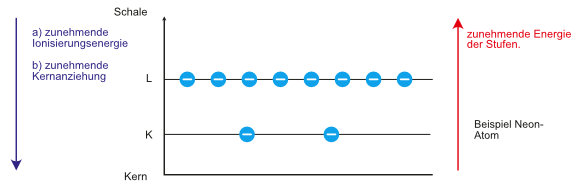
Beobachtung: Man benötigt immer mehr Energie, um das erste, zweite, dritte und die folgenden Elektronen vollständig abzutrennen.
Folgerung: Der verbleibende „Rumpf“ wird immer positiver und damit erfordert die Abrennung der folgenden Elektronen immer größere Energie.
Beobachtung: Man benötigt zur Abspaltung der beiden letzten Elektronen (z.B. im Vergleich zum drittletzten Elektron) besonders viel Energie.
Folgerung: Die Elektronen des Neons lassen sich in zwei Gruppen einteilen.
- Die zwei Elektronen mit großer Ionisierungsenergie sind im zeitlichen Mittel näher am Kern.
- Die acht Elektronen mit relativ kleinen Ionisierungsenergien sind im zeitlichen Mittel weiter vom Kern entfernt.
{/sliders}
b. Energiestufenschema (Neon-Atom)
Ein Neon-Atom könnte man mit der Elektronenverteilung wie folgt aufschreiben:
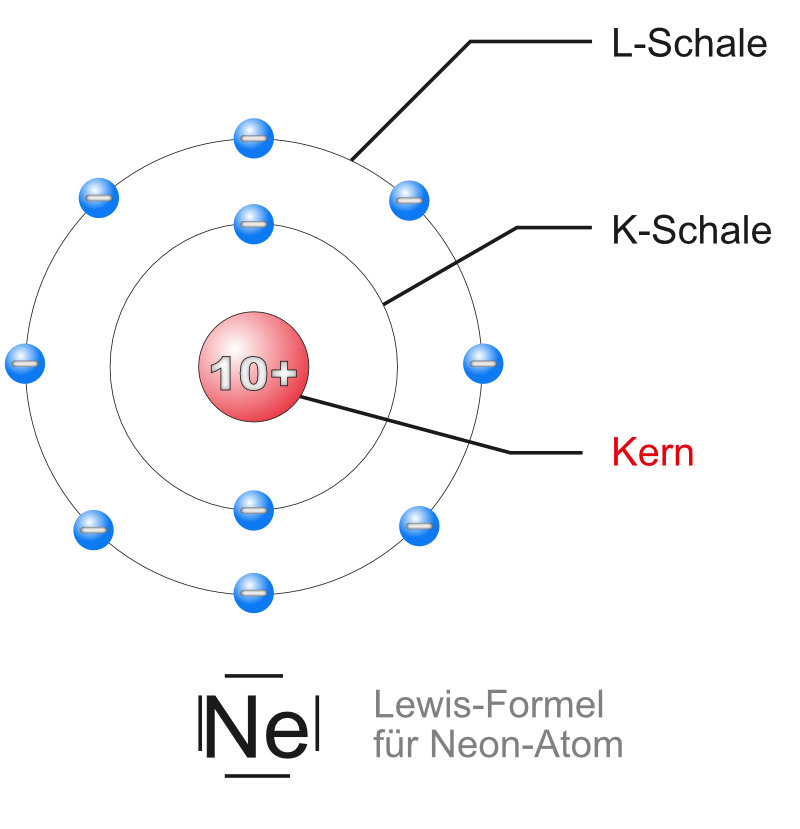
c. Schalenmodell (Neon-Atoms)
Die Energiestufen lassen sich als konzentrischen Kugelschalen um den Kern veranschaulichen. Man erhält damit ein „Schalenmodell“ des Neonatoms (mit Lewis-Formel). Hinweis: Der Kern ist zusammengefasst. Eigentlich müsste man dort 10 Protonen und 10 Neutronen zeichnen, aber das macht die Sache nicht anschaulicher. Deshalb nur ein "Kern" mit der Ladung.
Die Elektronen sind verteilt "auf" den Schalen dargestellt, die kugelförmig den Bereich der Elektronen angeben. In der inneren Schale sind es zwei Elektronen in der äußeren Schale acht.
Weitere Beispiele (Abbildungen aus der interaktiven Seite; ausführlichere Erklärungen siehe dort).
Schalenmodell eines Aluminium-Atoms
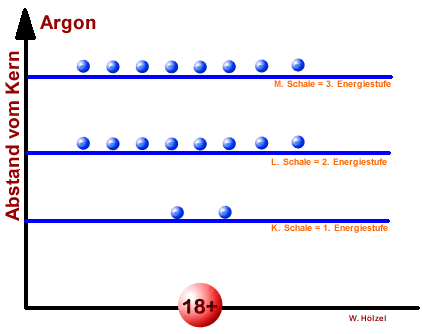
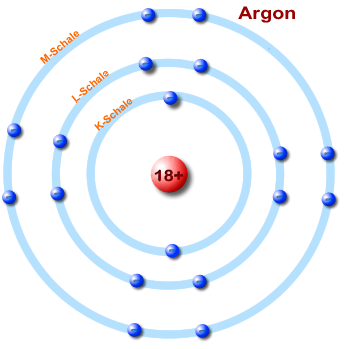
Vergleich - Energiestufen vers. Schalenmodell eines Argon-Atoms
Atomschalen
d) Postulate (= Grundannahmen) von Niels Bohr:
1. Die Elektronen bewegen sich nur auf ganz bestimmten, genau definierten Bahnen (= Energiestufen, Energieschalen, Schalen) um den Atomkern. Die Elektronen bewegen sich nicht zwischen dieser Energiestufen.
2. Jede Schale kann maximal 2 n² Elektronen aufnehmen
n = Schalennummer
n = 1, 2, 3, 4, ...
K, L, M, N, ... Schale
3. Für jede Bahn, auf der das Elektron den Atomkern umkreist, hat das Elektron eine bestimmte Energie. Auf der K-Schale (n = 1), die dem Atomkern am nächsten ist, kommt dem Elektron die geringste Energie zu.
- Details
- Geschrieben von: Wolfram Hölzel