4 Anwendungen
4.1 Volta-Element (Voltasche Säule)
(vgl. ABs)
Alessandro Volta entwickelt um 1800 die erste funktionsfähige Batterie, die „Voltasche Säule“, aus Zink- und Kupfer-Platten, zwischen die mit Schwefelsäure getränkter Filz gelegt wurde. Um die Spannung zu erhöhen, stapelte er bis zu 20 Plattenpaare übereinander.
Modellversuch zum Volta-Element
(vgl. AB Schülerübungen)
Versuch a
Gasentwicklung nur an der Zinkelektrode:
Überlege Dir dafür die Reaktionsgleichung:
{slider title="Lösung" open="false" class="icon"}
Zn (s) + 2 H₃O¹⁺ (aq) → Zn²⁺ (aq) + H₂ + 2 H₂O
{/sliders}
Versuch b
An der Phasengrenze Metall/Lösung bilden sich folgende Gleichgewichte aus:
Zn (s) ⇄ Zn²⁺ (aq) + 2 e⁻
Cu (s) ⇄ Cu²⁺ (aq) + 2 e⁻
Die Lösungstendenz der Zinkatome ist größer als die Lösungstendenz der Kupferatome. Die gemessene Spannung ist charakteristisch für die Kombination dieser beiden Redoxpaare.
Versuch c
Bei Stromfluss fließen auf Grund der vorhandenen Spannung Elektronen vom Zink zum Kupfer. Dort werden die Elektronen von den Oxonium-Ionen (Hydronium-Ionen)
Überlegt euch die Halbreaktionen und die gesamte Teilchengleichung:
{slider title="Lösung" open="false" class="icon"}
Oxidation, - Pol Zn → Zn²⁺ (aq) + 2 e⁻
Reduktion, + Pol 2 H₃O¹⁺ (aq) + 2 e⁻ → H₂ + 2 H₂O
Gesamte Teilgleichung: Zn (s) + H₃O¹⁺ (aq) → Zn²⁺ (aq) + H₂ + 2 H₂O
{/sliders}
Vergleich Daniell-Element und Volta-Element
Überlegt euch einmal die Unterschiede beider historischen Galvanischen Zellen:
{slider title="Lösung" open="false" class="icon"}
Im Daniell-Element liegt eine galvanische Zelle aus einer Zink- und einer Kupfer-Halbzelle vor, beim Volta-Element aus einer Zink- und einer Wasserstoff-Halbzelle.
{/sliders}
- Details
- Geschrieben von: Wolfram Hölzel
4.2 Bleiakkumulator (1859, Gaston Planté)
Vgl. AB
Versuch 1
Herstellung: Man taucht zwei Bleiplatten in 20%-ige Schwefelsäure (H₂SO₄). Die beiden Bleiplatten überziehen sich mit einer weißen Schicht.
Erklärung: Blei (Pb) steht in der Spannungsreihe über dem Wasserstoff, somit läuft zunächst folgende Redox-Reaktion ab:
Formuliert die Reaktionsgleichung (nutzt -sofern vorhanden- die Tabelle des Standardelektrodenpotentials:
{slider title="Lösung" open="false" class="icon"}
Pb (s) + 2 H₃O⁺ (aq) + SO₄²⁻(aq) → PbSO₄ (s) ↓ + H₂ (g) + H₂O (l)
Die Pb²⁺-Ionen bilden sofort mit den SO₄²⁻-Ionen das schwerlösliche Salz Bleisulfat (PbSO₄). Dieses weiße, schwerlösliche Bleisulfat überzieht die beiden Bleiplatten; die Redox-Reaktion kommt zum Stillstand.
{/sliders}
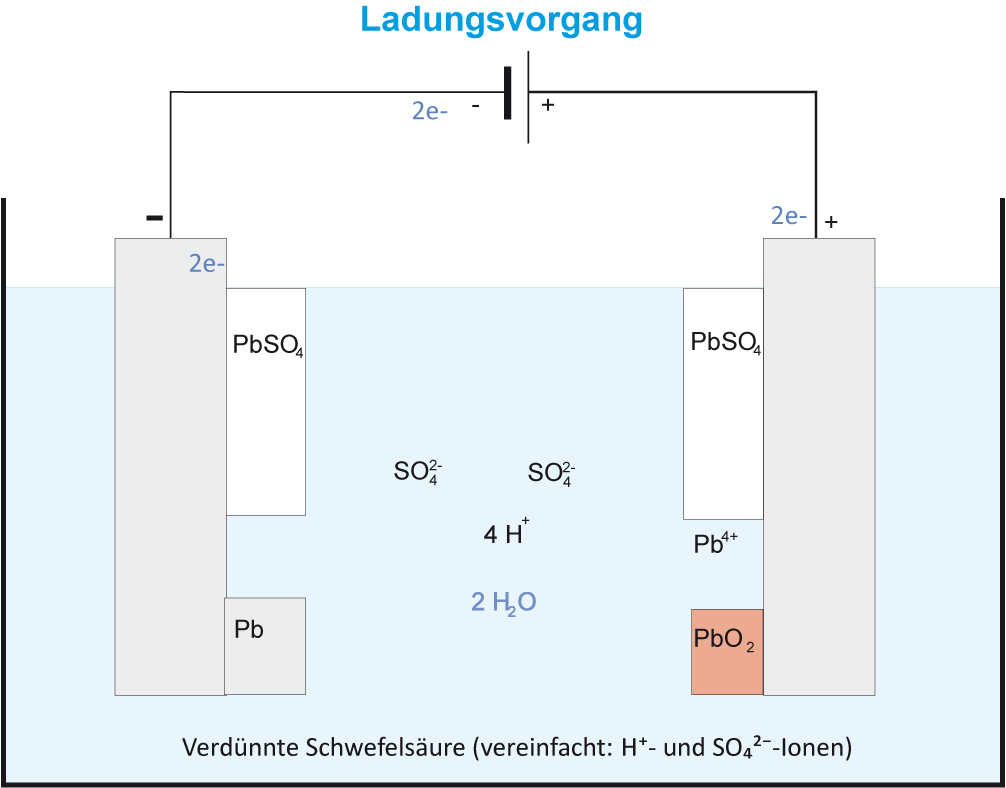
Jetzt tauen zwei gleiche Elektroden in den gleichen Elektrolyten (Schwefelsäure), somit besteht keine Spannung zwischen den Elektroden.
Die Aufladung des Bleiakkus erfolgt durch Elektrolyse.
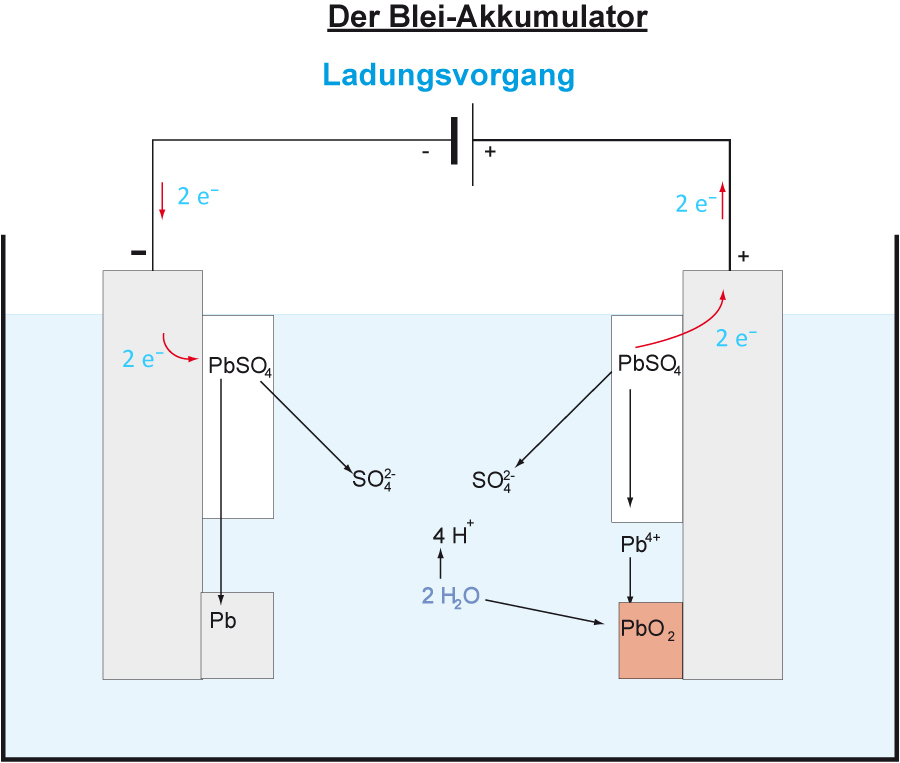
Versuch 2: Aufladung
Möglicher Versuchsaufbau:
Merke: An der Anode (+ Pol) spielt sich die Oxidation, an der Kathode (- Pol) die Reduktion ab.
Formuliert mögliche Teilreaktionen:
{slider title="Lösung" open="false" class="icon"}
Oxidation (+Pol): Pb²⁺ + 2 H₂O → PbO₂ + 4 H⁺ + 2 e⁻ Es scheidet sich festes PbO₂ (Salz aus Pb²⁺ und O²⁻-Ionen aufgebaut) ab, die Schwefelsäure wird „konzentrierter“.
Reduktion (-Pol): Pb²⁺ + 2 e⁻ → Pb Es scheidet sich auf der Elektrode schwammi-ges Blei ab.
{/sliders}
Ergänzt einmal die Pfeile beim Ladungsvorgang
{slider title="Lösung" open="false" class="icon"}
{/sliders}
Formuliert mögliche Gesamtreaktion:
{slider title="Lösung" open="false" class="icon"}
Gesamtreaktion beim Laden:
Pb²⁺ + 2 H₂O → Pb + PbO₂ + 4 H⁺
2 PbSO₄ + 2 H₂O → Pb + PbO₂ + 4 H⁺ + 2 SO₄²⁻
{/sliders}
Nun tauchen zwei verschiedene Elektroden (Pb und PbO₂ ) in die Elektrolytlösung. Zwischen diesen beiden Elektroden besteht eine Spannung von etwa 2 Volt. Der Bleiakku besteht im geladenen Zustand aus einer schwammig porösen Blei-Elektrode und einer rotbraunen Blei(II)-oxid-Elektrode. Als Elektrolyt dient 20-30%ige Schwefelsäure.
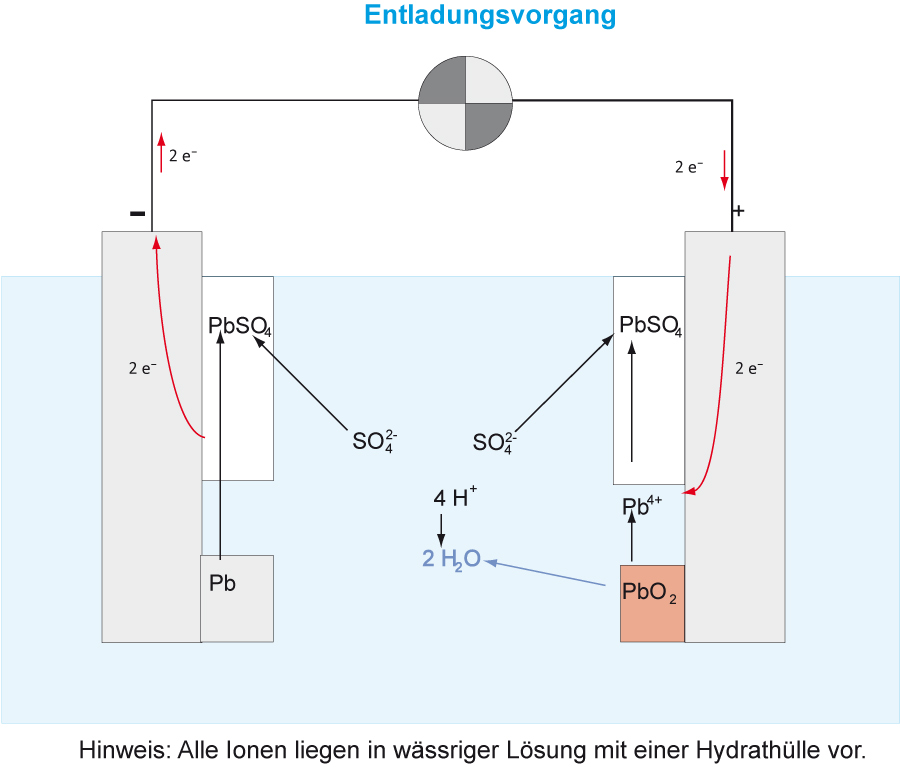
Versuch 3: Entladung
Formuliert auch für die Entladung die Teilreaktionen und die Gesamtreaktion:
{slider title="Lösung" open="false" class="icon"}
Oxidation (- Pol) Anode: Pb → Pb²⁺ + 2 e⁻ Die Anode überzieht sich mit schwerlöslichen Bleisulfat (PbSO₄ )
Reduktion (+ Pol) Kathode: PbO₂ + 4 H⁺ + 2 e⁻ → Pb²⁺ + 2 H₂O Die Kathode überzieht sich ebensfalls mit schwerlöslichem Bleisulfat (PbSO₄).
Gesamtreaktion beim Entladen:
Pb + PbO₂ + 4 H⁺ → 2 Pb²⁺ + 2 H₂O
Pb + PbO₂ + 4 H⁺ + 2 SO₄²⁻ → 2 PbSO₄ + 2 H₂O
{/sliders}
Abschließend: Wie müssten die Pfeile beim Entladevorgang verlaufen?
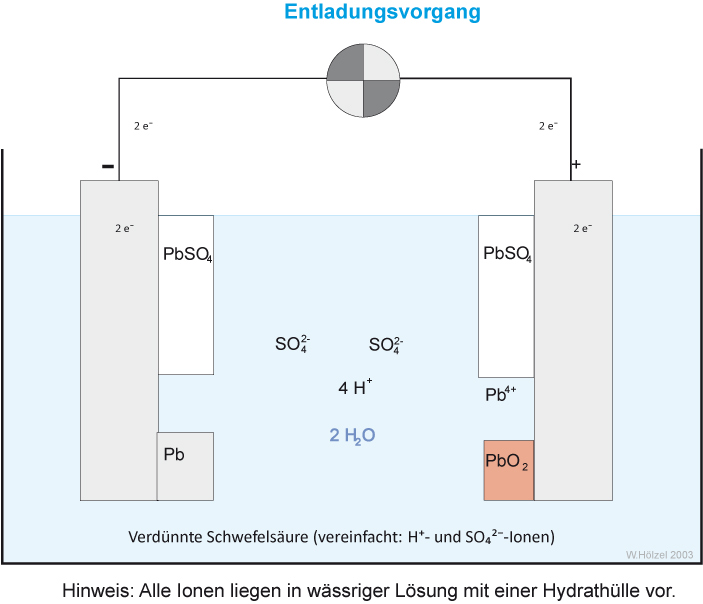
{slider title="Lösung" open="false" class="icon"}
{/sliders}
- Details
- Geschrieben von: Wolfram Hölzel
4.3 Brennstoffzelle
Vergl. dazu auch AB!
Versuch 1: Herstellung einer Brennstoffzelle im Modellversuch: Elektrolyse einer Phosphorsäure (50%).
Am Minuspol wird Wasserstoff, am Pluspol Sauerstoff gebildet.
Es liegt also ein saurer Elektrolyt vor. Wenn ihr für diese Reaktionen in eure Tabelle schaut, achtet auf die Reaktionen mit Oxonium-Ionen.
Formuliere dafür die Halbreaktionen und die Gesamtreaktion:
{slider title="Lösung" open="false" class="icon"}
Oxidation: + Pol: 6 H₂O → O₂ + 4 H₃O⁺(aq) + 4 e⁻
Reduktion: - Pol: 4 H₃O⁺(aq) + 4 e⁻ → 2 H₂ + 4 H₂O
Gesamtreaktion: 2 H₂O → 2 H₂ + O₂
{/sliders}
Brennstoffzelle mit saurem Elektrolyten
Die Elektronen fließen von der mit Wasserstoff zu der mit Sauerstoff umspülten Elektrode.
Formuliere dafür die Halbreaktionen und die Gesamtreaktion:
{slider title="Lösung" open="false" class="icon"}
Oxidation: - Pol: 2 H₂ + 4 H₂O → 4 H₃O⁺(aq) + 4 e⁻
Reduktion: +Pol: O₂ + 4 H₃O⁺(aq) + 4 e⁻ → 6 H₂O
Gesamtreaktion: 2 H₂ + O₂ → 2 H₂O
{/sliders}
Versuch 2: Herstellung einer Brennstoffzelle im Modellversuch: Elektrolyse einer 1 Kalilauge mit c = 1 mol/L.
Formuliere dafür die Halbreaktionen und die Gesamtreaktion:
{slider title="Lösung" open="false" class="icon"}
Oxidation: + Pol: 4 OH⁻ (aq) → O₂ + 2 H₂O + 4 e⁻
Reduktion: - Pol: 4 H₂O + 4 e⁻ → 2 H₂ + 4 OH⁻ (aq)
Gesamtreaktion: 2 H₂O → 2 H₂ + O₂
{/sliders}
Brennstoffzelle mit alkalischen Elektrolyten
Die Elektronen fließen von der mit Wasserstoff zu der mit Sauerstoff umspülten Elektrode.
Formuliere dafür die Halbreaktionen und die Gesamtreaktion:
{slider title="Lösung" open="false" class="icon"}
Oxidation: -Pol: 2 H₂ + 4 OH⁻(aq) → 4 H₂O + 4 e⁻
Reduktion: +Pol: O₂ + 2 H₂O + 4 e⁻ → 4 OH⁻ (aq)
Gesamtreaktion: 2 H₂ + O₂ → 2 H₂O
{/sliders}
- Details
- Geschrieben von: Wolfram Hölzel
4.4 Weitere Batterien
Def.: ortsunabhängige elektrochemische Spannungsquellen
Allg.:
Minuspol: unedles Metall (Reduktionsmittel) [Zn, Li, Na]
Pluspol: starkes Oxidationsmittel
4.4.1 Leclanché-Batterie
Aufbau:
Minuspol: Stahlummantelter Zinkbecher
Pluspol: Graphitstab umgeben von einem Gemisch von Graphitpulver und Braunstein (MnO₂)
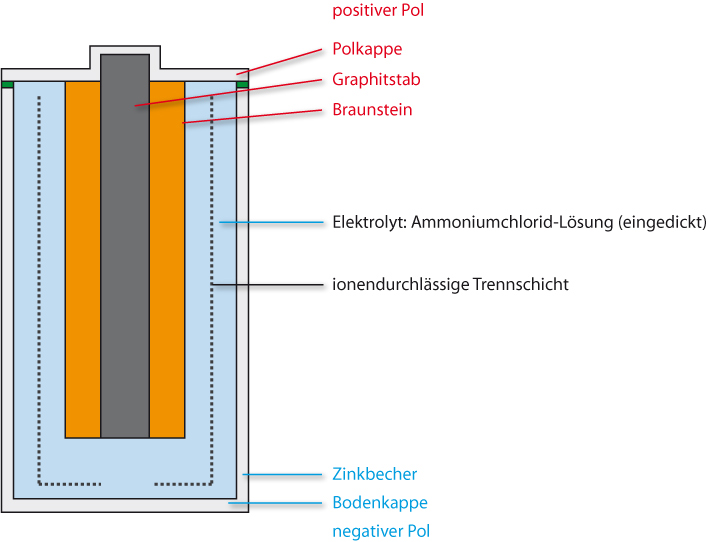
Versucht nun mit Hilfe von eurer Tabelle die Teilreaktionen zu formulieren.
{slider title="Lösung" open="false" class="icon"}
Minuspol (Ox): Zn (s) → Zn²⁺ (aq) + 2 e⁻
{/sliders}
Zusatzinformationen:
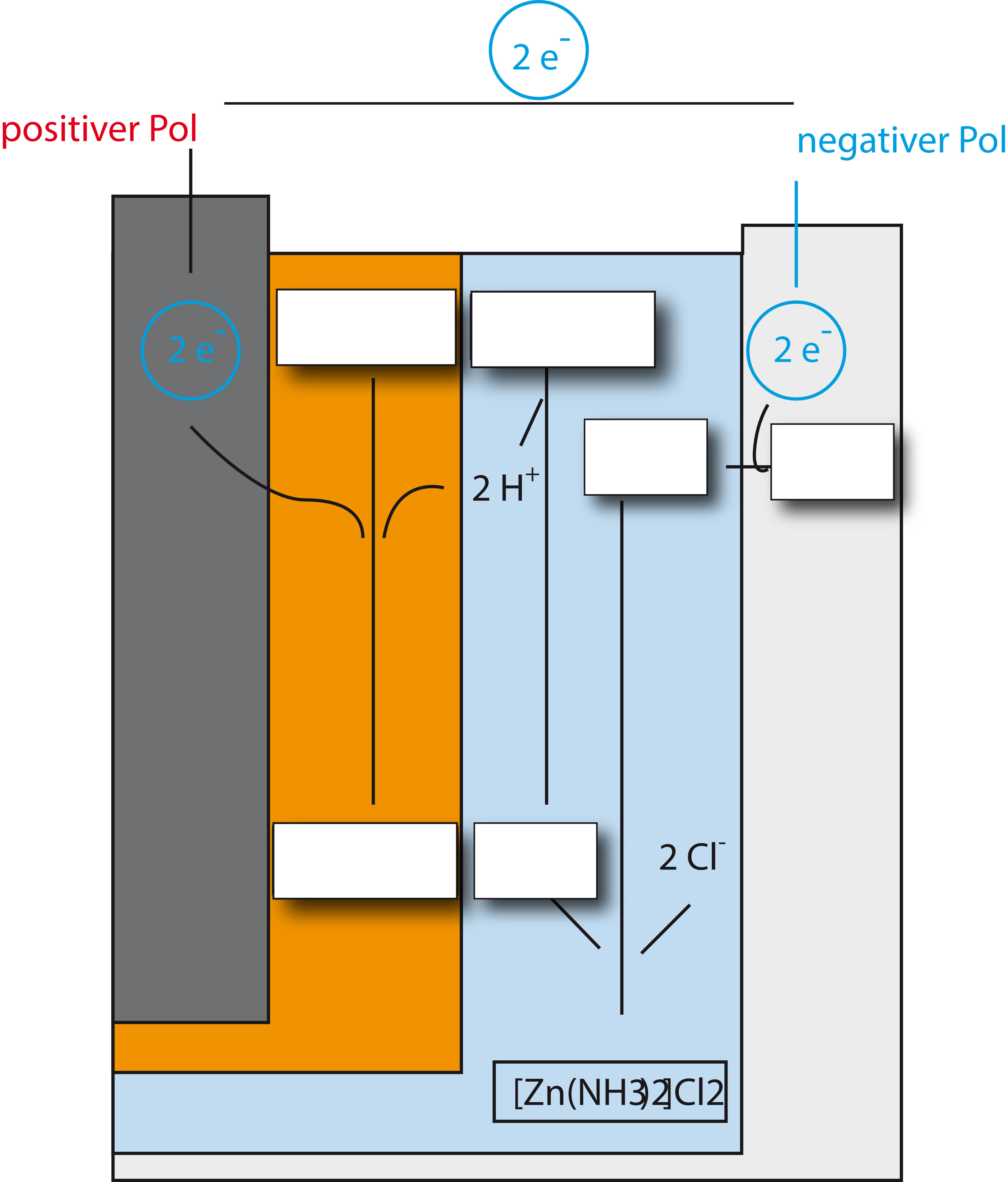
In der Batterie laufen noch weitere, komplexere Vorgänge ab:
Sekundärreaktion:
NH₄⁺(aq) + H₂O(l) ⇌ NH₃ (aq) + H₃O⁺ (aq)
[Oxonium-Ionen werden am Pluspol verbraucht, GG-Verschiebung nach rechts (Le Chatelier)]
Komplexe Bindung von Ammoniak (= Diamminzink-Ionen)
[Zn(NH₃)₂]²⁺ (aq) + 2 Cl⁻ (aq) → [Zn(NH₃)₂]Cl₂ (s)
Diese Vorgänge werden im folgenden Schaubild dargestellt. Versucht mal die Lücken zu füllen:
{slider title="Lösung" open="false" class="icon"}
{/sliders}
- Details
- Geschrieben von: Wolfram Hölzel
4.4.2 Alkali – Mangan-Batterie
Aufbau: Stahl- statt Zinkbehälter (Auslaufsicher)
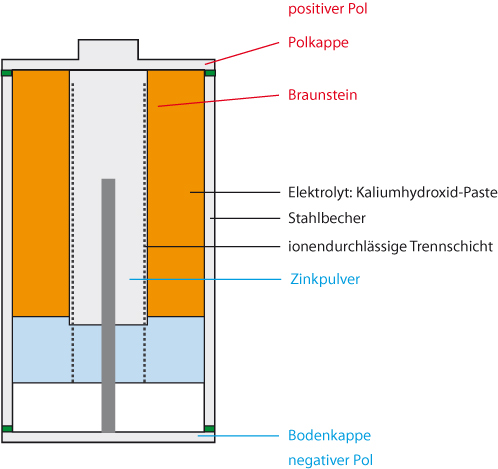
Zinkpulver ⇨ größere Oberfläche ⇨ höhere Entladeströme ohne Spannungsabsenkung
Elektrolyt: Kaliumhydroxid: lösliche Hydroxozinkat-Ionen [Zn(OH)₄]²⁻
Elektrodenreaktionen wie bei Leclanche:
Formuliert nochmals dafür die Reaktionsgleichungen (ohne nachzuschauen):
{slider title="Lösung" open="false" class="icon"}
Minuspol (Ox): Zn (s) → Zn²⁺ (aq) + 2 e⁻
Pluspol (Red): ![]()
Bzw.: 
{/sliders}
4.4.3 Zink/Luft-Batterie
Oxidationsmittel: Luft (anstatt Braunstein)
Elektrolyt: Kaliumhydroxid – Lösung
Graphitelektrode: Kat für Sauerstoff
Versucht mal die Teilreaktionen zu schreiben (Oxidation und Reduktion und ordnet das dem Plus- und Minuspol zu).
{slider title="Lösung" open="false" class="icon"}
Minuspol (Ox): 2 Zn (s) → 2 Zn²⁺ (aq) + 4 e⁻
Pluspol (Red): O₂(g) + 2 H₂O(l) + 4 e⁻ → 4 OH⁻
{/sliders}
→ reagiert weiter zu [Zn(OH)₄]²⁻ (Hydroxozinkat-Ionen)
Benutzung: Großbatterie für Langzeitanwendungen (Weidezaun, Baustelle, …)
4.4.4 Silberoxid-Batterie
Oxidationsmittel: Silberoxid (anstatt Braunstein)
Elektrolyt: Kaliumhydroxid – Lösung
Bitte auch hier nochmals die Halbreaktionen formulieren. Der Minuspol bleibt immer noch gleich:
{slider title="Lösung" open="false" class="icon"}
Minuspol (Ox): 2 Zn (s) → 2 Zn²⁺ (aq) + 4 e⁻
Pluspol: Ag₂O (g) + H₂O (l) + e⁻ → 2 Ag (s) + 2 OH⁻ (aq)
{/sliders}
Vorteil: Stabile Spannung von 1,5 V (gesamte Betriebszeit);
- Details
- Geschrieben von: Wolfram Hölzel