1.4 Brownsche Molekularbewegung
Versuch 1:
Durchführung:
1. Schritt: Vollmilch und Wasser wird im Verhältnis 1:1 vermischt.
2. Schritt: 1 Tropfen wird auf dem Objektträger gegeben und mit einem Deckgläschen bedeckt.
3. Milch-Wasser-Tropfen wird mikroskopiert.
Beobachtung: Die Fetttropfen bewegen sich (zittern).
Ergebnis:
Brownsche Molekularbewegung: Bewegung, die die Teilchen in allen Aggregatzuständen (fest, flüssig, gasförmigen) ausüben.
1.5 Diffusion
vgl. Versuche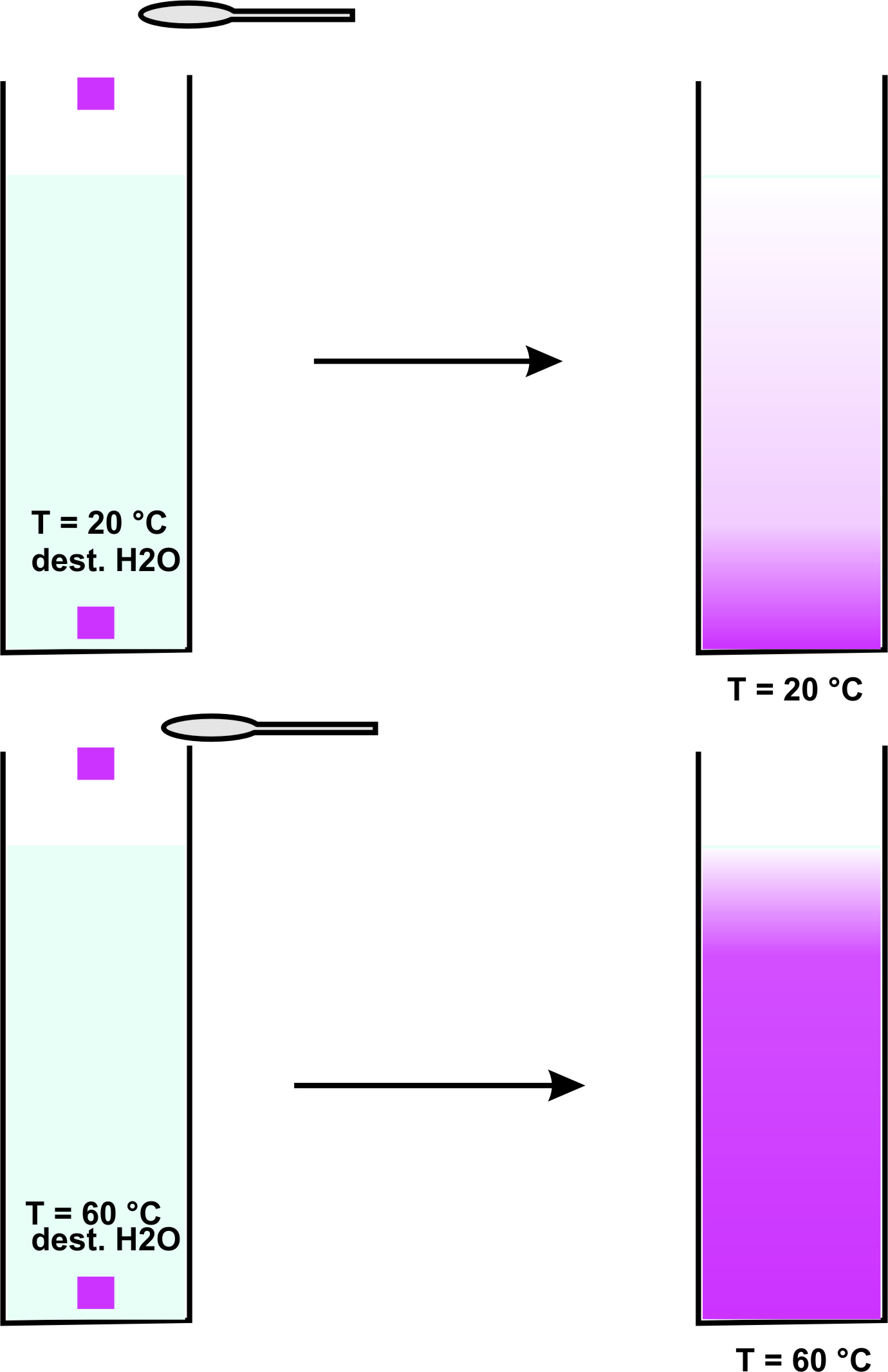
Beobachtung:
Die Kristalle lösen sich unter Schlierenbildung auf. Mit der Zeit verteilen sich die Ionen (= geladene Teilchen) gleichmäßig.
Dabei läuft die Verteilung im warmen Wasser schneller ab als im kalten.
Die Teilchengeschwindigkeit ist umso höher, je höher die Temperatur ist.
Die Diffusion erfolgt umso schneller, je
- höher die Temperatur
- kleiner die Teilchen
- kürzer die Strecke
Diffusion ist in einem Gas schneller als in einer Flüssigkeit.
1.6 Löslichkeit
Flüssigkeiten (z.B. Wasser, Brennspiritus), die Stoffe (z.B. Zucker, Kaliumnitrat) lösen, heißen Lösungsmittel. Gelöst werden können Feststoffe, Flüssigkeiten und Gase. Ein Lösungsmittel kann nicht jeden Stoff lösen. Nimmt die Lösung keinen weiteren Stoff mehr auf, so ist die Lösung gesättigt.
• Leicht löslich: Lösungsmittel: 100 g Wasser, bei 20 °C: es lösen sich 204 g Zucker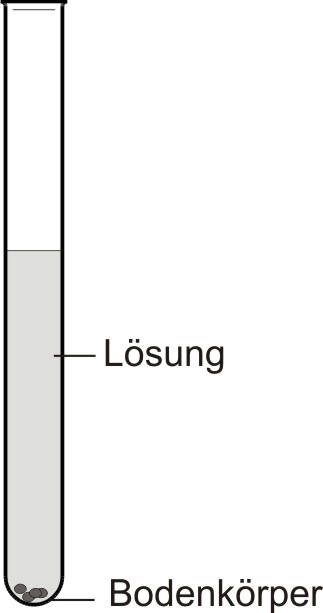
• Schwer löslich: Lösungsmittel: 100 g Wasser, bei 20 °C: es lösen sich 0,2 g Gips
• Bodenkörper: fester Stoff, der sich nicht weiter löst.
Bei vielen festen und flüssigen Stoffen nimmt die Löslichkeit mit steigender Temperatur zu.
Bei Gasen nimmt die Löslichkeit mit steigender Temperatur ab.
KTM-Erklärung für das Lösen von Zucker in Wasser:
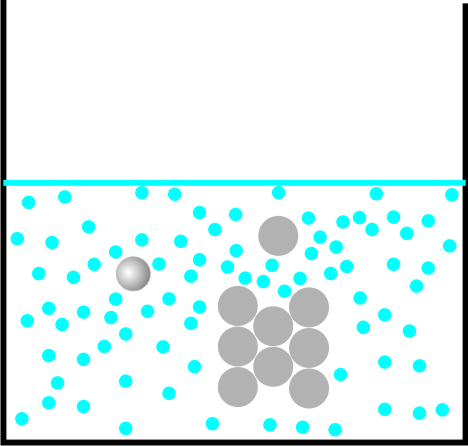
Die sich bewegende Wasserteilchen schieben sich zwischen die Zucker-Teilchen und lösen sie aus dem Kristall.
1.6.1 Kristalle
- Kristalle sind gekennzeichnet durch geometrisch regelmäßige Anordnung ihrer Außenflächen und Kanten. Kristalle sind immer durch Ebenen begrenzt.
Nichtkristalline (amorphe) Stoffe haben dagegen gekrümmte Flächen als Begrenzung (Bsp. Glas, Kunststoff) - Entstehung von Kristallen:
- aus heißgesättigten Lösungen durch Abkühlen (z.B. Kupfersulfat)
- aus kaltgesättigten Lösungen durch Verdunsten des Lösungsmittel [möglichst langsam] (z.B. Zucker)
- aus Dämpfen durch Erstarren
- aus Schmelzen durch Erstarren
