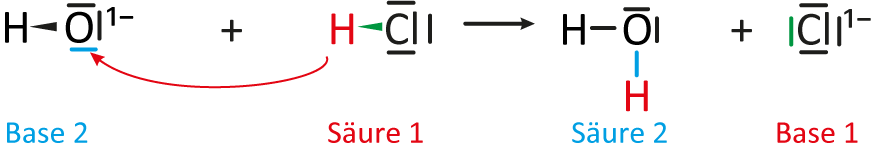Säure-Base-Reaktionen (=Protolyse-Reaktionen)
In diesem Kapitel geht es um die zweite Möglichkeit, wie eine chemische Reaktion ablaufen kann. Dabei werden zunächst einige typische Beispiele betrachtet. Danach wird die Definition (die bis dahin sowieso wohl schon vielen klar sein wird) aufgestellt.
1 Reaktion von Chlorwasserstoffgas mit festem Natriumhydroxid
Hinweis: Um die Vorgänge besser nachvollziehen zu können gibt es hier ein Periodensystem der Elemente-Popup
Ausgangsstoffe:
| Name | Summenformel | Strukturformel | Bindung |
| Chlorwasserstoff | HCl | Polare Atombindung | |
| Natriumhydroxid | NaOH | |
Ionenbindung |
a) Versuch:

b) Beobachtung:
Natriumhydroxid überzieht sich mit einem weißen Feststoff; am Ende des Glasrohres schlägt sich eine farblose Flüssigkeit nieder, das Reaktionsrohr erwärmt sich.
c) Auswertung: Folgende Teilchen reagieren miteinander:
I Teilchengleichung:
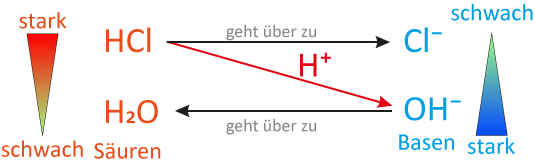
Na¹⁺OH¹⁻ + HCl → H₂O + Na¹⁺Cl¹⁻
NaOH(s) + HCl(g) → H₂O(l) + NaCl(s) ΔH < 0
d) Protolyse-Schema
Allgemeines Protolyse-Schema
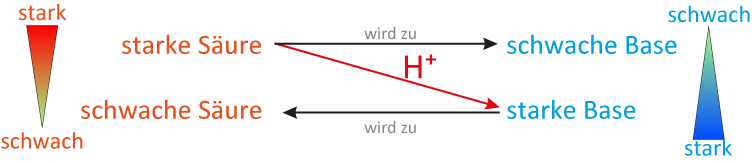
Ein Protolyse-Schema funktioniert analog zum Redox-Schema (siehe vorheriges Kapitel). Hier zunächst ein allgemeines Schema (welches für alle Säure-Base-Reaktion so gelten kann):
Protolyse-Sschema für die Bildung von Natriumchlorid
e) Erklärung der exothermen Reaktion
| ΔH > 0 (positiv, endotherm) | ΔH < 0 (negativ, exotherm) |
|
|
Ergebnis: ΔH < 0 (negativ, exotherm) überwiegt.