4.4 Weitere Batterien
Def.: ortsunabhängige elektrochemische Spannungsquellen
Allg.:
Minuspol: unedles Metall (Reduktionsmittel) [Zn, Li, Na]
Pluspol: starkes Oxidationsmittel
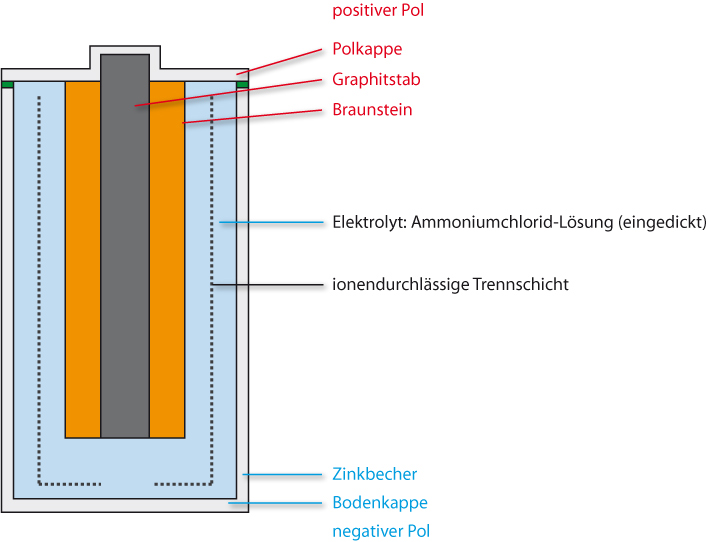
4.4.1 Leclanché-Batterie
Aufbau:
Minuspol: Stahlummantelter Zinkbecher
Pluspol: Graphitstab umgeben von einem Gemisch von Graphitpulver und Braunstein (MnO₂)
Versucht nun mit Hilfe von eurer Tabelle die Teilreaktionen zu formulieren.
{slider title="Lösung" open="false" class="icon"}
Minuspol (Ox): Zn (s) → Zn²⁺ (aq) + 2 e⁻
{/sliders}
Zusatzinformationen:
In der Batterie laufen noch weitere, komplexere Vorgänge ab:
Sekundärreaktion:
NH₄⁺(aq) + H₂O(l) ⇌ NH₃ (aq) + H₃O⁺ (aq)
[Oxonium-Ionen werden am Pluspol verbraucht, GG-Verschiebung nach rechts (Le Chatelier)]
Komplexe Bindung von Ammoniak (= Diamminzink-Ionen)
[Zn(NH₃)₂]²⁺ (aq) + 2 Cl⁻ (aq) → [Zn(NH₃)₂]Cl₂ (s)
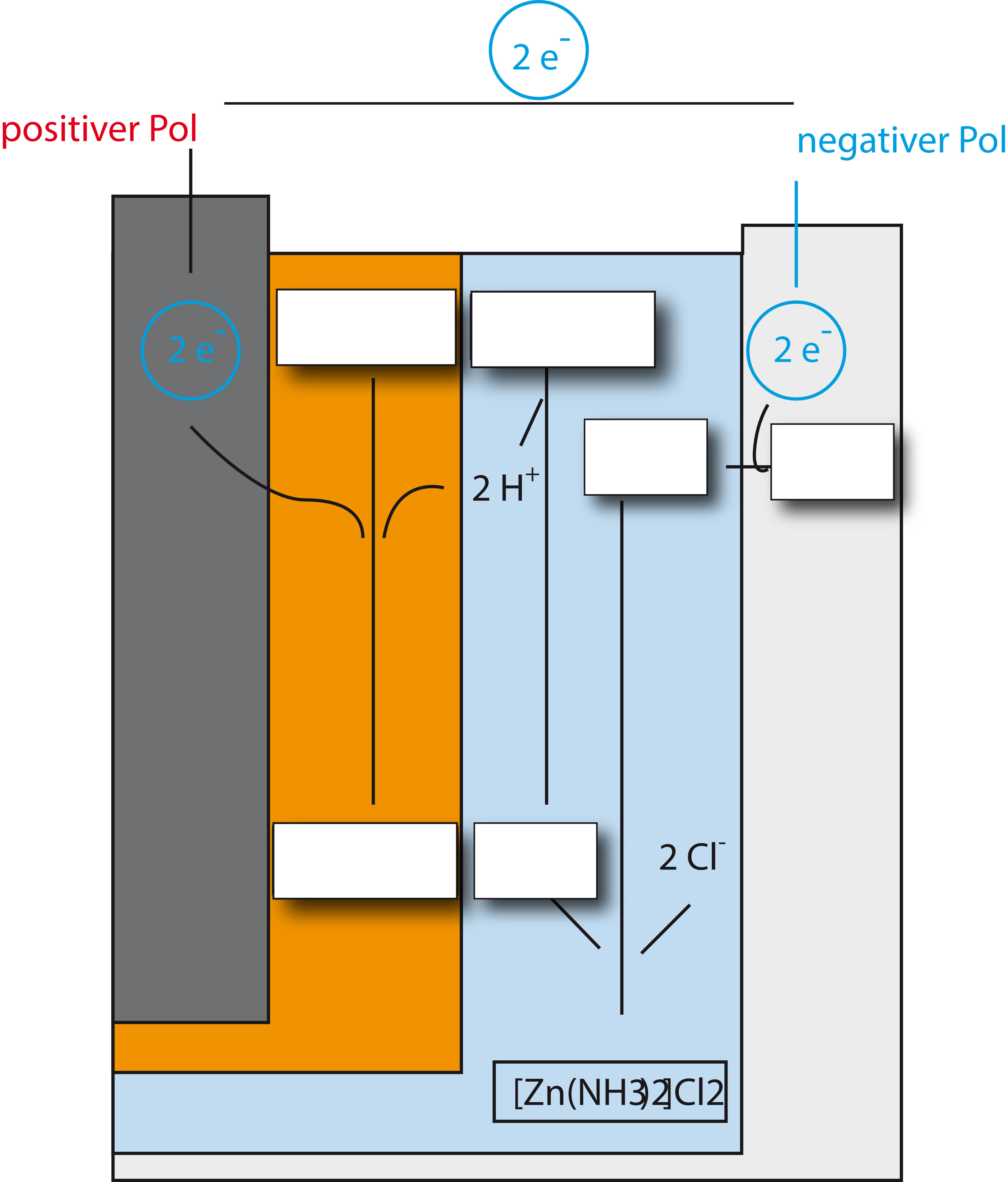
Diese Vorgänge werden im folgenden Schaubild dargestellt. Versucht mal die Lücken zu füllen:
{slider title="Lösung" open="false" class="icon"}
{/sliders}