2.5.1 Standardelektrodenpotential von Chlor (Chlorknallgaszelle)
Kombiniert man eine Chlorelektrode (Standardbedingungen) mit der Standardwasserstoffhalbzelle, so erhält man die Chlorknallgaszelle.
Versuch: Experimentelle Bestimmung des Normalpotentials von Chlor
Fehler in der Abbildung: V müsste 1,37 V sein.
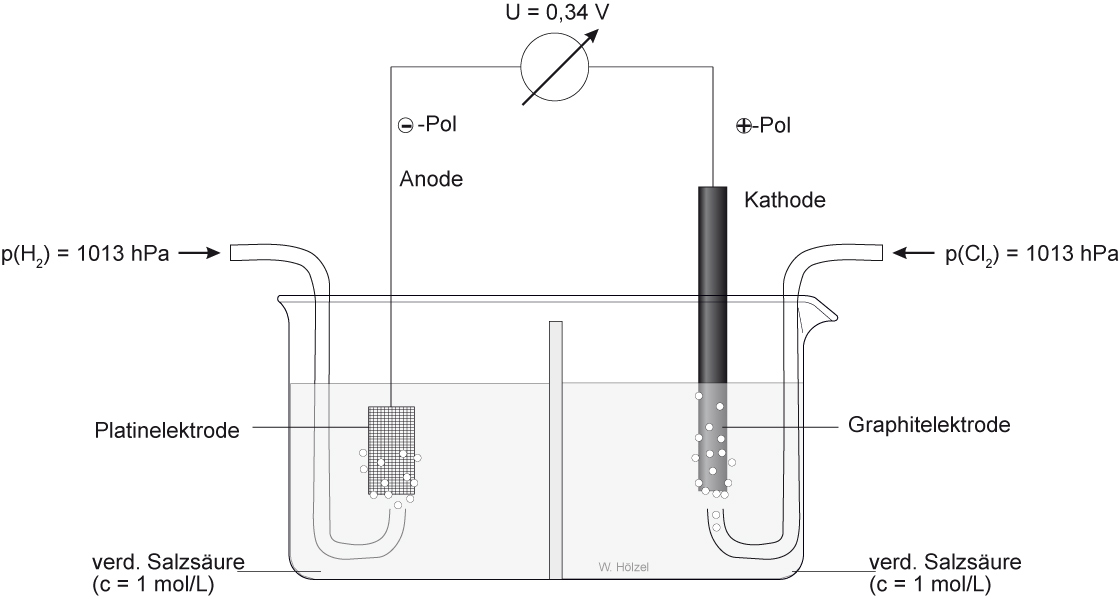
Zellendiagramm: H₂[Pt]/2 H⁺(c = 1 mol/L) //2 Cl⁻(c = 1 mol/L) / Cl₂ [C]
Oxidation; - Pol; Dontatorhalbzelle: H₂ → 2 H⁺ + 2 e⁻
Reduktion; + Pol; Akzeptorhalbzelle: Cl₂+ 2 e⁻ → 2 Cl⁻
--------------------------------------------------------------------------------------------------------------
Gesamtreaktion: H₂ + Cl₂ → 2 H⁺(aq) + 2 Cl⁻ (aq)
Man kann also die Reaktion zwischen Wasserstoff und Chlor auch unter Lieferung von elektrischer Energie ablaufen lassen.
