3 Innere Energie – U
Jeder Stoff hat in sich Energie in irgendeiner Form gespeichert = Innere Energie U,
äußere Energie = potenzielle Energie (wie z.B. Eisenblock auf dem Schrank) + kinetische Energie (z.B. der Eisenblock fliegt runter) ⇨ spielt keine Rolle für chemische Reaktionen.
Man unterscheidet vereinfacht:
- den physikalisch-thermischen (Bsp.: Rotationsenergie, Schwingungsenergie), Uth
- den chemischen (die potentielle Energie der Bindungskräfte bzw. die Bindungsenergie) Uch und
- den kernphysikalischen (potentielle Energie, die in den Atomkernen vorhanden) UK
.....Anteil der inneren Energie (U = UK + Uch + Uth)
Es lässt sich kein Absolutbetrag U stofflicher Systeme angeben, da sich kein Energienullpunkt festlegen lässt. Bestimmbar sind nur Änderungen der inneren Energie ΔU
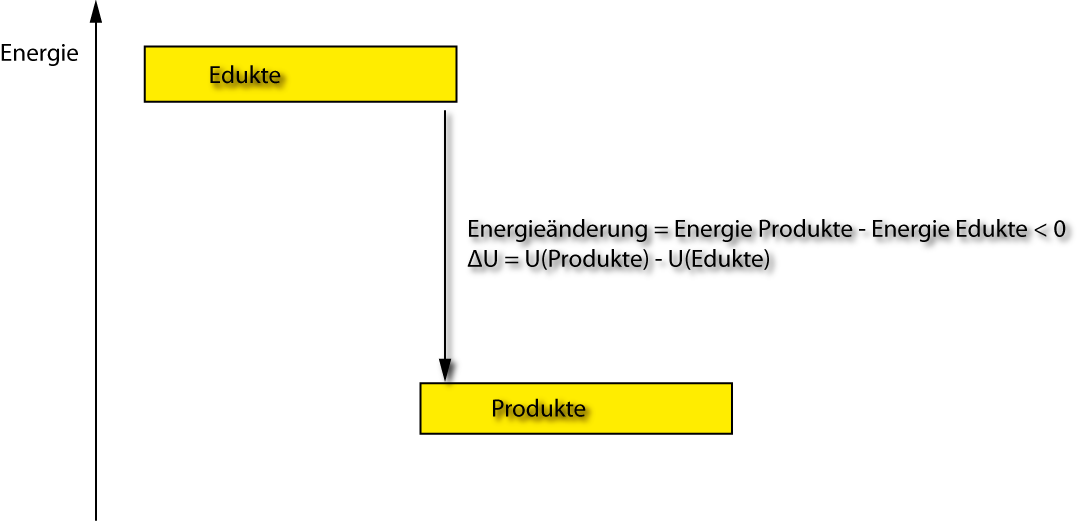
ΔU = U₂ – U₁
ΔU > 0 : Energie wird aufgenommen
ΔU < 0 : Energie wird abgegeben
U₂: Summe der inneren Energien der Produkte
U₁: Summe der inneren Energien der Reaktanden (Edukte)
Änderung der inneren Energie = Wärme + Arbeit
ΔU = U₂ – U₁ = Q + W
Innere Energie = Zustandsgröße
Zustandsgrößen: in einem bestimmten Zustand hat die Zustandsgröße einen bestimmten Wert. Dabei ist es egal, wie man diesen Zustand erreicht hat, also welchen Weg dafür beschritten hat.
Bsp.: Für die momentane potentielle Energie einer Person auf einem Berggipfel (Zustandsgröße) ist es gleichgültig, auf welchem Weg die Person den Gipfel erreicht hat. Die aufgewendete Arbeit hingegen, die die Person aufbringen muss, um diese potentielle Energie zu erreichen, hängt natürlich vom zurückgelegten Weg ab.
Zustandsgrößen: Volumen, Druck, Temperatur sind unabhängig von der Vorgeschichte des Systems (ob es vorher 50°C oder 20°C war).
Die Arbeit ist bei chemischen Reaktionen meistens Volumenarbeit.
