4. Quantitative Beziehungen
4.1 Quantitative Beziehungen bei chemischen Reaktionen
4.1.1 Gesetz von der Erhaltung der Masse
4.1.2 Gesetz von den konstanten Massenverhältnissen
4.2 Atommasse
4.3 Avogadro-Konstante NA
4.4 Die Stoffmenge n und das mol
4.5 Die Teilchenzahl N
4.6 Molare Masse M
4.7 Die Verhältnisformel
4.8 Moleküle
4.9 Verbindungen
4.10 Bedeutung von Formeln und Symbolen
- Details
- Geschrieben von: Wolfram Hölzel
4 Quantitative Beziehungen
4.1 Quantitative Beziehungen bei chemischen Reaktionen
4.1.1 Gesetz von der Erhaltung der Massen
Beispiel:
Kupfer (s) + Schwefel (s) → Kupfersulfid (s) ΔH < 0
Element Element Verbindung
Metall Nichtmetall
m(Kupferblech) m(Schwefel) m(Kupfersulfid)
1 g 0,25 g 1,25 g
1,25 g Ausgangsstoffe 1,25 g Endstoffe
Für chemische Reaktionen gilt allgemein:
Das Gesetz von der Erhaltung der Masse:
Bei chemischen Reaktionen ist die Masse der Ausgangsstoffe gleich der Masse der Endstoffe.
4.1.2 Gesetz von den konstanten Massenverhältnissen
Bsp.:
Kupfer + Schwefel → Kupfersulfid ΔH < 0
Massenverhältnisse mit denen Kupfer und Schwefel miteinander reagieren bzw. in welchem Massenverhältnis Kupfer und Schwefel im Kupfersulfid vorliegt ist m(Cu)/m(S) = 4/1

Es gilt das Gesetz der konstanten Massenverhältnisse:
Das Massenverhältnis, in dem Elemente eine chemische Verbindung bilden, ist konstant.
- Details
- Geschrieben von: Wolfram Hölzel
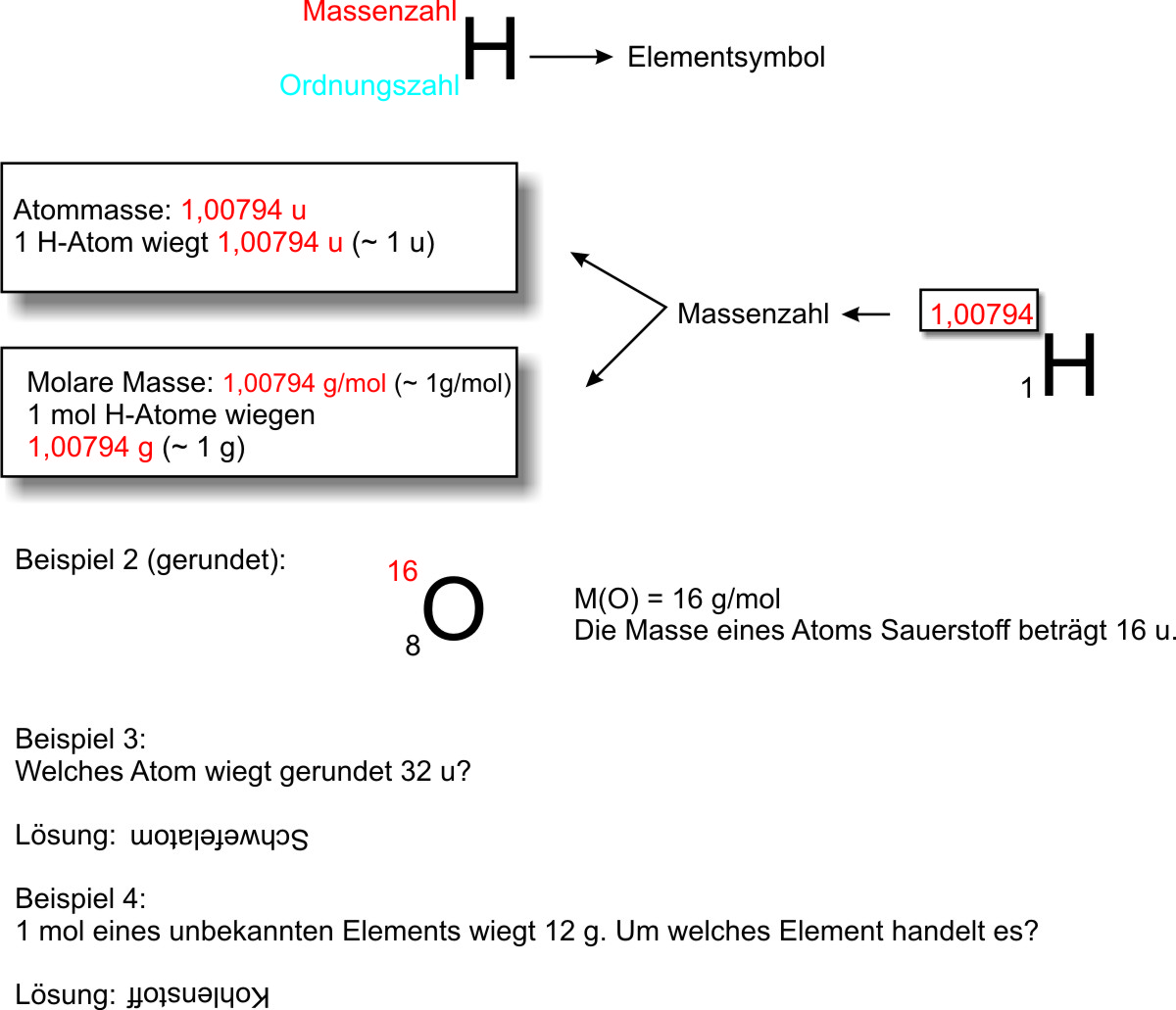
4.2 Atommasse
Die Masse eines einzelnen Atoms ist unvorstellbar klein.
Die geringste Masse besitzt ein Wasserstoffatom (H-Atom):
m(Wasserstoffatom) = 0, (23 Nullen) 1 67 g
m(H-Atom) = 0,000 000 000 000 000 000 000 001 67 g = 1,67 • 10-24 g = 1 u
Zur Erinnerung: 1 t = 1 000 kg = 10 • 10 • 10 kg = 10³ kg = 106 g = 109 mg
Eine Angabe der Atommasse in Gramm ist somit nicht sinnvoll. Man hat deshalb für die Atommasse eine eigene Einheit eingeführt:
die atomare Masseneinheit u (engl. unit = Einheit)
1 u entspricht etwa der Masse des Wasserstoff-Atoms.
Im PSE steht die Atommasse links über dem Elementsymbol. 1H
Zwischen der Einheit 1 g und 1 u besteht folgender Zusammenhang:
1 g = 602 200 000 000 000 000 000 000 u = 6,022 • 1023 u
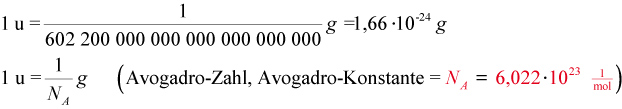
Veranschaulichung der Avogadro-Konstante:
- Länge Erdumfang: ~ 4 · 1010 mm
- Entfernung Erde-Mond: ~ 4 · 105 km ~ 4 · 1011 mm
- Fläche Erdoberfläche: ~ 5 · 108 km² ~ 5 · 1020 mm²
- Volumen Erdinhalt: ~ 1 · 1030 mm³
- Zeit seit Christi Geburt: ~ 6 · 1010 s
- 1 mol Ethanolmoleküle (C2H5OH) werden gleichmäßig in den Weltmeeren verrührt. Jetzt enthält jedes Liter Meerwasser (1,37 Milliarden km³) immer noch 460 Ethanolmoleküle.
Wie viel H-Atome wiegen genau ein Gramm?
1 g = 6,022·1023
Beispiele einiger Atommassen (gerundet)
| 1 H-Atom | hat die Masse | 1 u | 6,022 • 1023 H-Atome haben die Masse | 1g | 1 mol H-Atome haben die Masse | 1 g |
| 1 C-Atom | hat die Masse | 12 u | 6,022 • 1023 C-Atome haben die Masse | 12 g | 1 mol C-Atome haben die Masse | 12 g |
| 1 N-Atom | hat die Masse | 14 u | 6,022 • 1023 H-Atome haben die Masse | 14 g | 1 mol H-Atome haben die Masse | 14 g |
| 1 O-Atom | hat die Masse | 16 u | 6,022 • 1023 H-Atome haben die Masse | 16 g | 1 mol H-Atome haben die Masse | 16 g |
| 1 Mg-Atom | hat die Masse | 24 u | 6,022 • 1023 H-Atome haben die Masse | 24 g | 1 mol H-Atome haben die Masse | 24 g |
1 mol Ethanolmoleküle (C14 g
- Details
- Geschrieben von: Wolfram Hölzel
4.3 Avogadro-Konstante NA
Avogadro-Konstante (NA) gibt die Anzahl der Atome (bzw. Moleküle) an, die in einem Mol eines Stoffes enthalten sind; sie ist als Fundamentalkonstante definiert:
NA = 6,022 • 1023 1/mol
Immer 6,022 • 1023 hinzuschreiben ist zu aufwendig: Deshalb:
4.4 Die Stoffmenge n und das Mol
Man bezeichnet „6,022 • 1023 Teilchen“ (Atome, Moleküle, etc.) als 1 mol.
Definition:
Die Stoffmenge (n) beträgt 1 mol, wenn eine Stoffportion NA Teilchen (6,022•1023 Teilchen) enthält.
1 mol = 6,022•1023 Teilchen
(ähnlich, nur viel weniger: 1 Dutzend = 12 Teilchen)
n = 1 mol = 6,022·1023 Teilchen = 1 NA
n = 2 mol = 12,044·1023 Teilchen = 2 · NA
4.5 Die Teilchenzahl N
Definition: 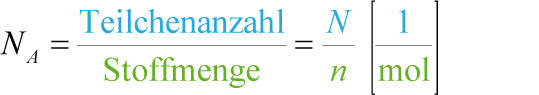
a) Zur Berechnung der Anzahl der Teilchen (= Teilchenzahl = N) gilt folgende Formel:
N = n · NA
Bsp.:
(I) Wie viel Teilchen Wasserstoff sind in 1 mol Wasserstoff enthalten?
N(H) = n(H) • NA = 1 mol • 6,022•10²³ 1/mol = 6,022•10²³
(II) Wie viel Teilchen Kohlenstoff sind in 2 mol Kohle enthalten?
N(C) = n(C) • NA = 2 mol • 6,022•10²³ 1/mol = 12,044•10²³
b) Wie viel Mol Kohlenstoff sind in 3,011•10²³ enthalten?
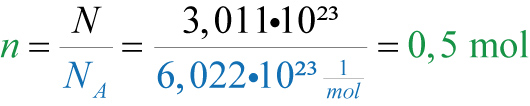
- Details
- Geschrieben von: Wolfram Hölzel
4.6 Molare Masse M
Def.: Die molare Masse ist die Masse von 1 mol eines Stoffes und wird in der Einheit g/mol angegeben.
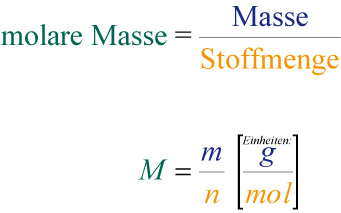
Bsp.:
M(H) = 1 g/mol
M(C) = 12 g/mol
Achtung: Bei der Angabe der molaren Masse (M), der Teilchenzahl (N), der Masse (m) oder der Stoffmenge (n) müssen wir immer die Teilchenart, auf die sich die Größe bezieht, in Klammern hinter dem Größenzeichen schreiben. Zum Beispiel m(H) oder n(H2O).
Angaben der Atommassen im PSE
- Details
- Geschrieben von: Wolfram Hölzel
