5 Alkanol, Alkohol
5.1 Ethanol, Trinkalkohol, Weingeist
5.1.1 Herstellung
Alkoholische Gärung:
Mikroorganismen (z.B. Hefe = Pilze) nutzen diesen Stoffwechselweg zur Energiegewinnung, wenn kein Sauerstoff vorhanden ist (= anaerobe Bedingungen). Dabei werden Kohlenhydrate (vor allem Glucose) mit Hilfe von Enzymen (Biokatalysatoren) in Kohlenstoffdioxid und Ethanol umgewandelt.
Zucker (Glucose) --(Hefe)--> Ethanol + Kohlenstoffdioxid ΔH < 0
Ferner entstehen Glycerin, Methanol, „Fuselalkohole“ (= höhere Alkohole), Aldehyde, Ketone, organische Säuren und Ester.
Bei einem Volumenanteil von etwa 14% Ethanol stellen die meisten Hefen ihre Tätigkeit ein.
Problem: Wie kann höher konzentriertes Ethanol gewonnen werden?
Lösung:
Destillation: Ein Verfahren zur Trennung von Flüssigkeitsgemischen durch Verdampfen und anschließender Kondensation des Dampfes.
Vgl. AB .
5.1.2 Eigenschaften
a) physikalische
- farblose Flüssigkeit
- Siedetemperatur: +78°C
- Schmelztemperatur: -114°C
- Gute Mischbarkeit mit Wasser und Benzin (SE )
b) chemische
- brennbar
- Details
- Geschrieben von: Wolfram Hölzel
5 Alkanol, Alkohol
5.1 Ethanol, Trinkalkohol, Weingeist
5.1.1 Herstellung
5.1.2 Eigenschaften
5.1.3 Formelermittlung von Ethanol
5.1.4 Versuch Ethanol reagiert mit Alkalimetall
5.1.5 Induktiver Effekt
5.1.6 Alkoholismus
5.2 Homologe Reihe der Alkohole, Alkanole
5.2.1 Alkohole bestehen aus zwei verschiedenen Gruppen
5.2.2 Einige wichtige Alkohole
5.2.3 Löslichkeit von primären und unverzweigten Alkoholen
5.2.4 Primäre, sekundäre und tertiäre Alkohole
5.2.5 Allgemeine Molekülformel der Alkohole (Alkanole)
5.2.6 Mehrwertige Alkohole
5.3 Chemische Reaktionen von Alkohol, Alkanol (am Beispiel von Ethanol)
5.3.1 Bindungsverhältnisse
5.3.2 Ethanol und Natrium (Redoxreaktion)
5.3.3 Verbrennung von Ethanol
5.3.4 Reaktion von Ethanol mit Bromwasserstoffsäure
5.3.5 Reaktion von Ethanol mit konzentriert Schwefelsäure
5.4 Ether
5.4.1 Herstellung
5.4.2 Physikalische Eigenschaften
5.4.3 Chemische Eigenschaften
5.4.4 Verwendungen
- Details
- Geschrieben von: Wolfram Hölzel
5.1.3 Formelermittlung von Ethanol
I. Qualitative Elementaranalyse
Versuch 1: Verbrennungsanalyse
- Ethanol verbrennt zu Wasser und Kohlenstoffdioxid;
- Nachweis von CO₂: Kalkwasser (weißer NS)
- Nachweis von H₂O: Watesmo-Papier wird blau
1. Ergebnis: Ethanol enthält somit zumindest C und H.
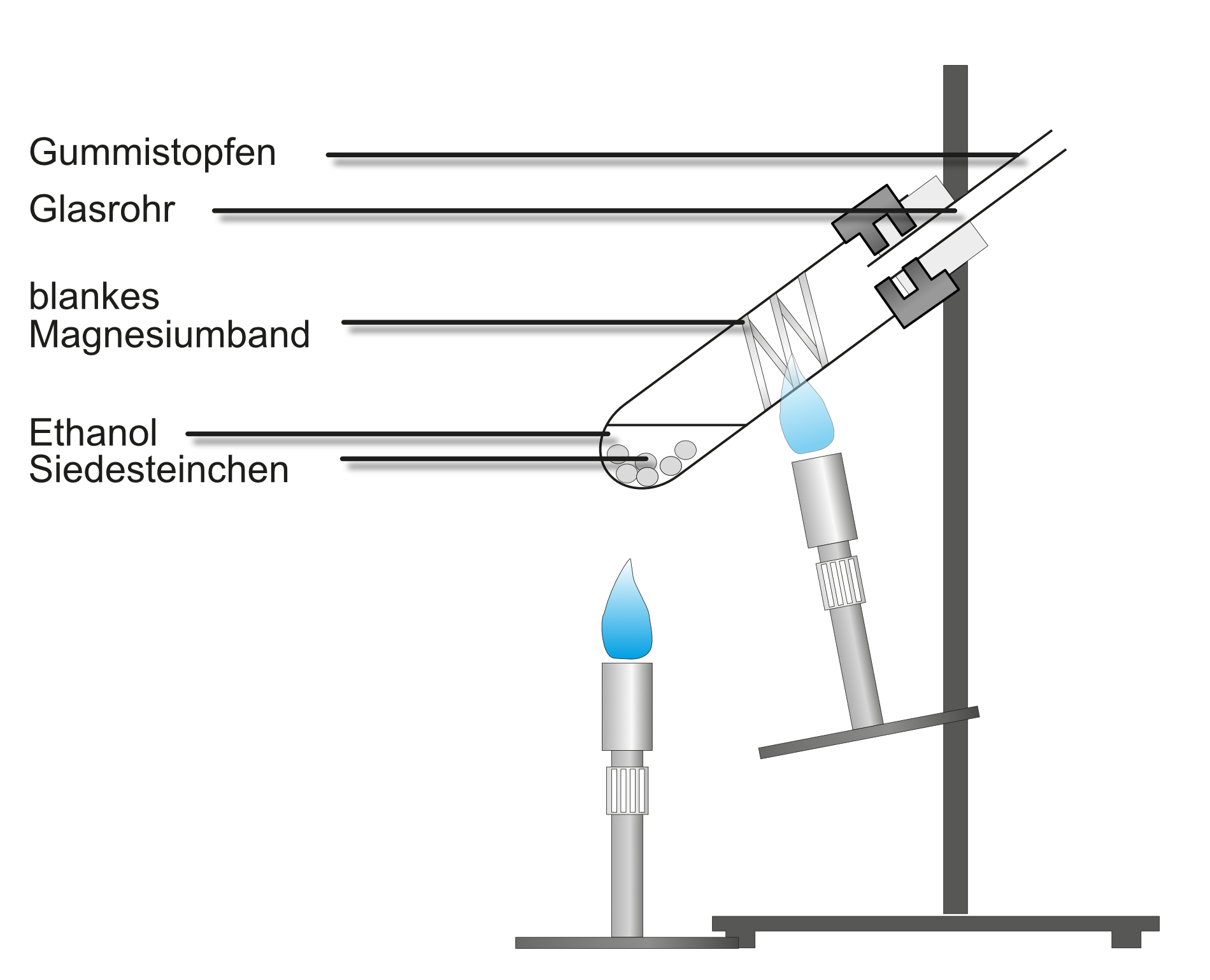
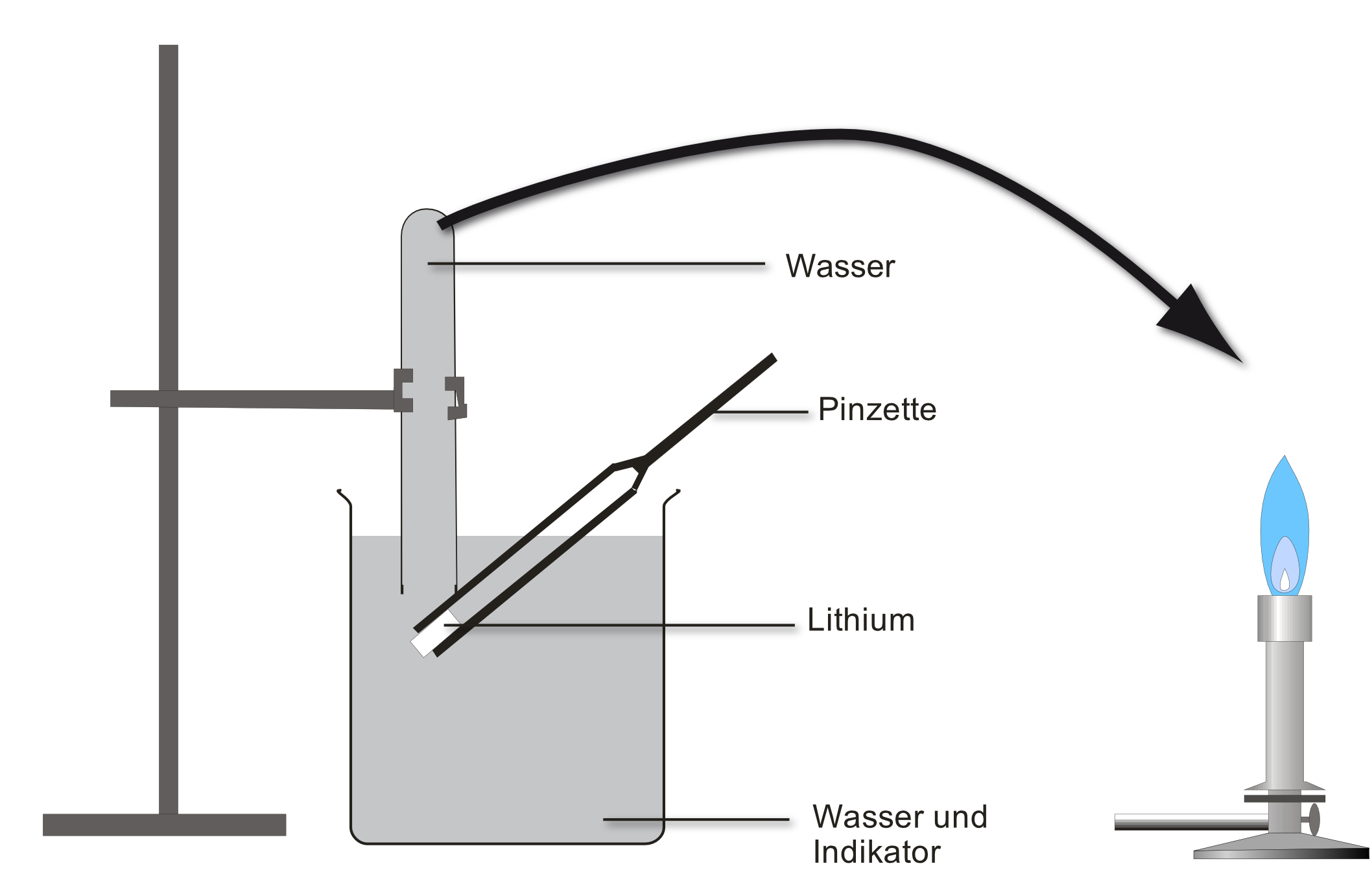
Versuch 2: Ethanol reagiert mit Magnesium - Sauerstoffnachweis
Durchführung:
- Aufbau siehe Abbildung
- Zunächst wird das Magnesiumband zum Glühen gebracht
- Danach verdampft man den Alkohol, der über das glühende Magnesiumband streicht.
Beobachtung:
Sobald Ethanol über das glühende Magnesiumband streicht glüht dieses heller auf und es bleibt ein kristalliner weißer Feststoff (Magnesiumoxid) übrig.
Ergebnis:
- Ethanol enthält neben Kohlenwasserstoff und Wasserstoff noch Sauerstoff.
II. Molekülmassenbestimmung (Verdampfungsmethode)
Hinweis: Dieser Versuch nur bei ausreichender Zeit durchgeführt. Nicht wundern, falls ihr das nicht im Heft stehen habt (dann kommt es auch in der Klausur nicht dran).
{slider title="Molmassenbestimmung nur bei viel Zeit" open="false" class="icon"}
Versuch: Molmassenbestimmung von Ethanol
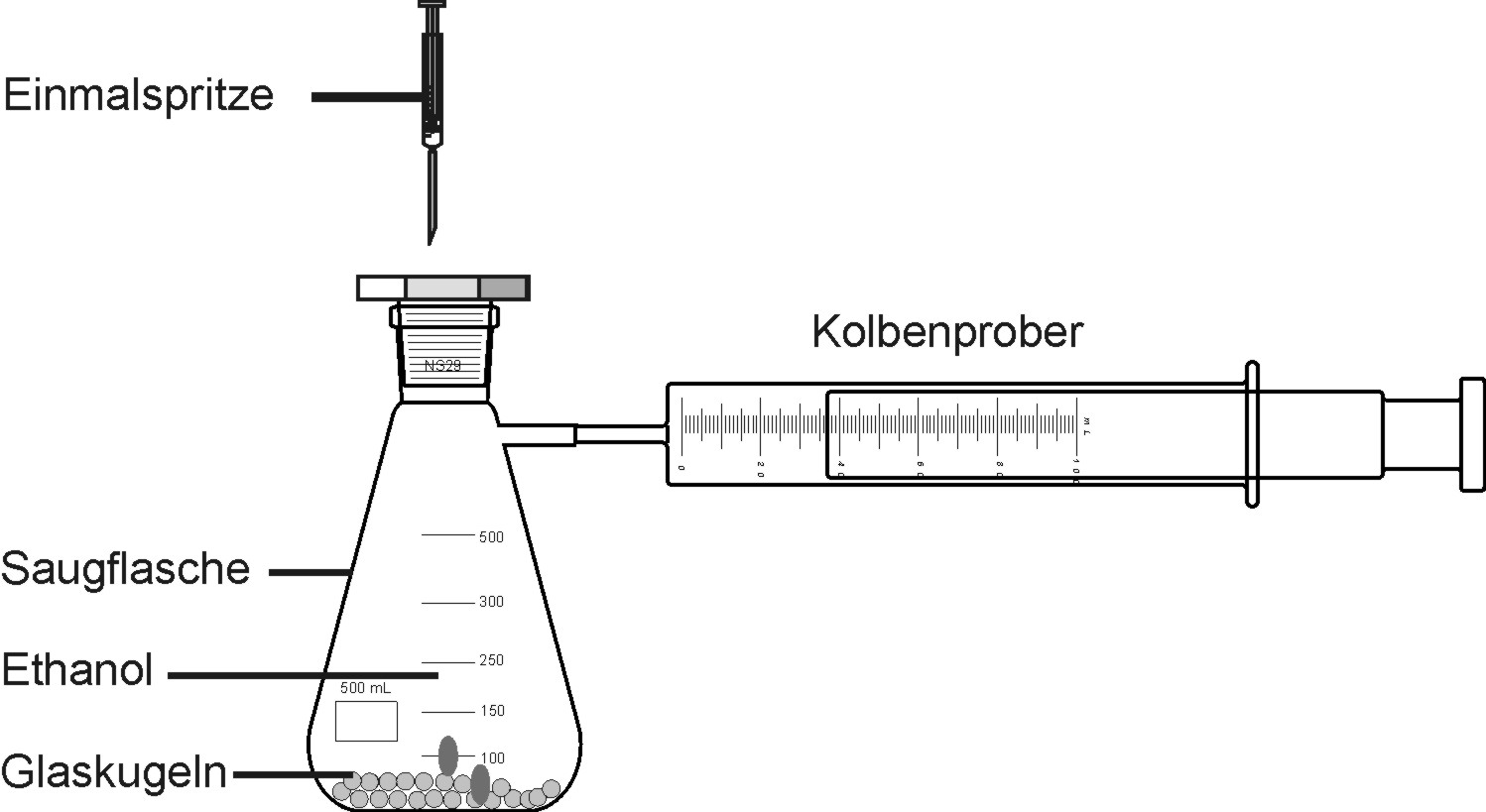
In den Erlenmeyerkolben werden 0,1 ml Ethanol eingespritzt. Auf der vergrößerten Oberfläche der Glasperlen wird das Ethanol leicht verdampft. Das entsprechende Gasvolumen kann am Kolbenprober abgelesen werden.
Auswertung:
0,1 ml Ethanol haben bei Standardbedingungen (SATP)* (25°C) ein Dampfvolumen von 43 ml.
0,1 ml Ethanol haben bei Normalbedinungen (0°C) ein Dampfvolumen von 37,8 ml.
Eingesetzte Masse Ethanol: über Dichte:
ρ = Dichte
m = Masse
V = Volumen
Rechnung:
37,8 ml Ethanol (NB) haben die Masse 0,079 g: ρ = m/V = 0,079 g/37,8 ml = 0,0021 g/ml
Über das molare Gasvolumen bei Normalbedingung Vm (Gas) = 22,4 L kann man die Molmasse berechnen.
1 mol Ethanoldampf unter NB haben die Masse:
M(Ethanol) = (0,079 g * 22 400 ml)/37,8 ml = 46,8 g (Dreisatz)
{/sliders}
Literaturwert: M(Ethanol) = 46 g/mol.
_______________
* SATP-Bedingungen (Standard Ambient Temperature and Pressure)
- Details
- Geschrieben von: Wolfram Hölzel
III. Quantitative Elementaranalyse
46g Ethanol ergeben bei der Verbrennung 88 g CO₂ und 54 g H₂O
- in 2 mol CO₂ sind 2 mol C (24g) enthalten
- in 3 mol H₂O sind 6 mol H (6g) enthalten
46 g Ethanol enthalten somit 2 mol C (24g) und 6 mol H (6g) und 1 mol (16g).
Atomzahlverhältnis im Ethanol: C : H : O = 2 : 6 : 1
Verhältnisformel: C₂H₆O₁
Molekülformel: C₂H₆O (Molekülmasse = 46u)
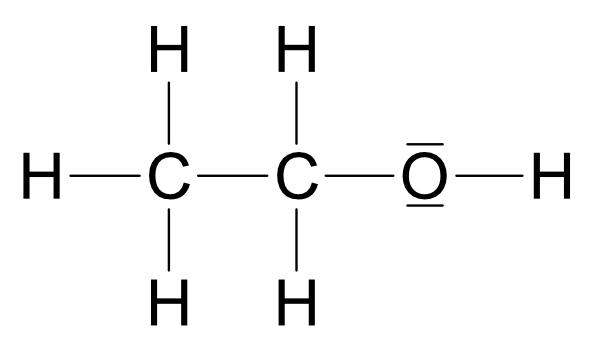
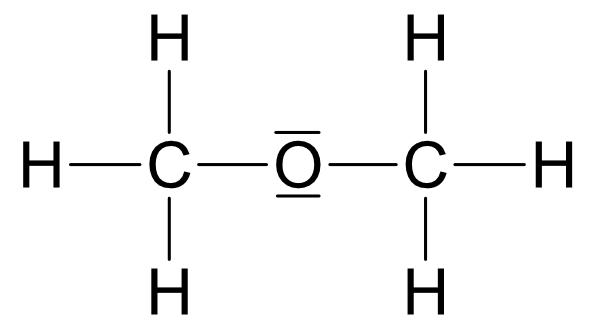
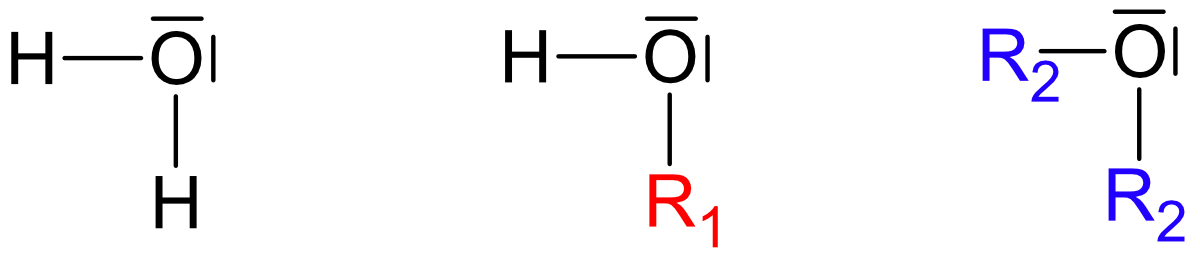
IV. Ermittlung der Strukturformel von C₂H₆O
Zwei Möglichkeiten:
Wichtig: Ethanol und Dimethylether sind Derivate (Abkömmlinge) des Wassers.
Beide Strukturen leiten sich vom Wasser ab, jedoch ist Struktur a wasserähnlicher.
R1 = - C₂H₅ (Ethylrest)
R2 = - CH₃ (Methylrest)
Siedepunkt: Struktur a +78°C und Struktur b -25°C
Um herauszufinden, welche dieser Strukturen auf Ethanol zutrifft bitte nächste Seite anschauen.
- Details
- Geschrieben von: Wolfram Hölzel
5.1.4 Versuch: Ethanol + Alkalimetall
Versuch: Ein Stück Lithium ( SE ) wird auf Ethanol, Benzin und Wasser gegeben. Alternativ kann man die Experimente auch mit Natrium als Lehrerversuch durchführen. Die Reaktionsgleichungen sind mit dem Alkalimetall Natrium formuliert. Für Lithium gilt es analog.
Bei Wasser ist der Aufbau etwas komplizierter:
Beobachtung: Gasentwicklung; das entstehende Gas ist brennbar; Natrium „verschwindet“; die neu entstandene Lösung leitet den elektrischen Strom; dampft man die Lösung ein, entsteht ein weißer Feststoff.
Ergebnis:
Ethanol (Struktur a) reagiert mit Natrium unter Wasserstoffbildung. Struktur b (Dimethylether) würde so nicht reagieren, da sich kein Proton abspalten kann. Somit besitzt Ethanol die Strukturformel:
1. Natrium + Wasser
a) Teilchengleichung (mit Strukturformeln)
| 2 Na (s) | + | 2 H₂O (l) | → | 2 NaOH (aq) | + | H₂ (g) |
| Natrium | Wasser | Natriumhydroxid | Wasserstoff | |||
| fest | flüssig | gelöst | gasförmig |
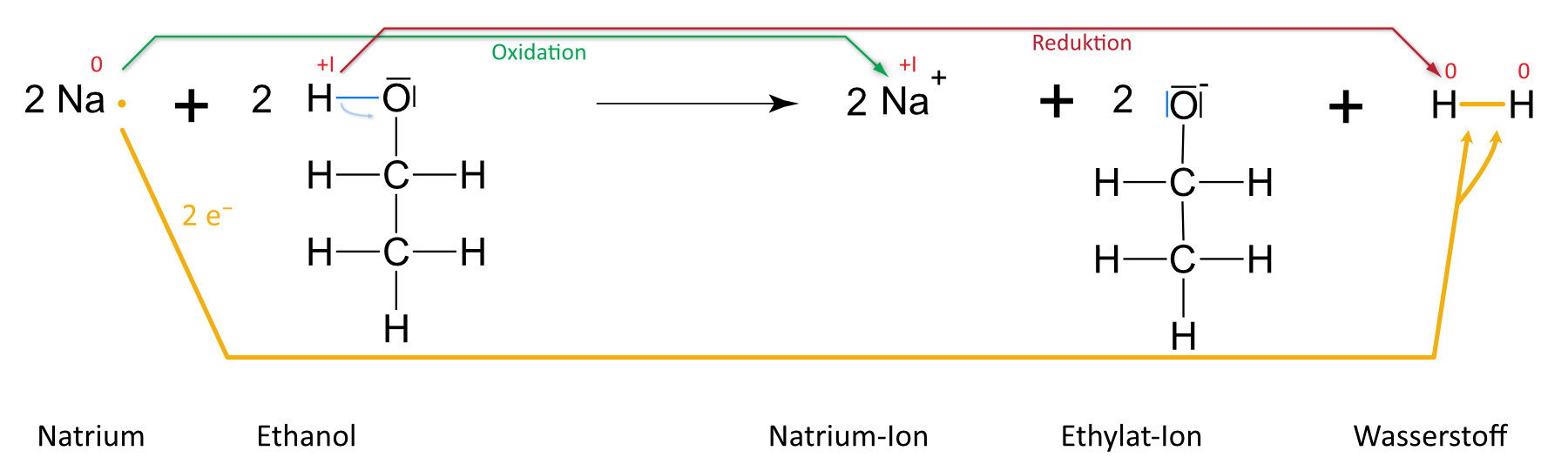
2. Natrium + Ethanol
Man kann Ethanol ja als Derivate (=Abkömmlinge) von Wasser betrachten. Wasser hat ein Sauerstoff-Atom und zwei Wasserstoff-Atome; Ethanol hat ein Sauerstoff-Atom, ein Wasserstoff-Atom und eine Ethyl-Gruppe. Beim Ethanol ist also ein Wasserstoff-Atom durch eine Ethylgruppe ersetzt. Wenn wir diese Alkylgruppe als "Rest" betrachten, dann zeigt sich die Verwandtschaft von Ethanol mit Wasser. Hat man also die Reaktionsgleichung von Wasser mit Natrium verstanden, dann müsste einem auch die Reaktionsgleichung von Ethanol (und anderen Alkoholen) leichtfallen. Versucht nun einmal, die Reaktion von Natrium mit Ethanol zu formulieren.
a) Teilchengleichung (mit Strukturformeln)
{slider title="Lösung" open="false" class="icon"}
{/sliders}
b) Reaktionsgleichung
{slider title="Lösung" open="false" class="icon"}
2 Na (s) + 2 C₂H₅OH (l) 2 NaC₂H₅O (aq) + H₂ (g)
{/sliders}
Auswertung: Es ist keine „klassische“ Säure-Base-Reaktion nach Brönstedt. Grund: +I-Effekt (vgl. unten) der Methylgruppe (Protonierung ist erschwert). Es handelt sich hier um eine Redoxreaktion (Veränderung der Oxidationenszahlen). Formal geben zwei Moleküle Ethanol je ein Proton ab. Jedes Proton nimmt von einem Natrium- bzw. Lithiumatom ein Elektron auf; es bilden sich so zwei Wasserstoffatome, die sich zu einem Wasserstoffmolekül zusammenlagern. Analog, nur heftiger, verläuft die Reaktion mit Wasser.
Weitere Übungen:
Lithium und Methanol
Formuliert auch dafür die Reaktionsgleichung (vgl. oben)
{slider title="Lösung" open="false" class="icon"}
{/sliders}
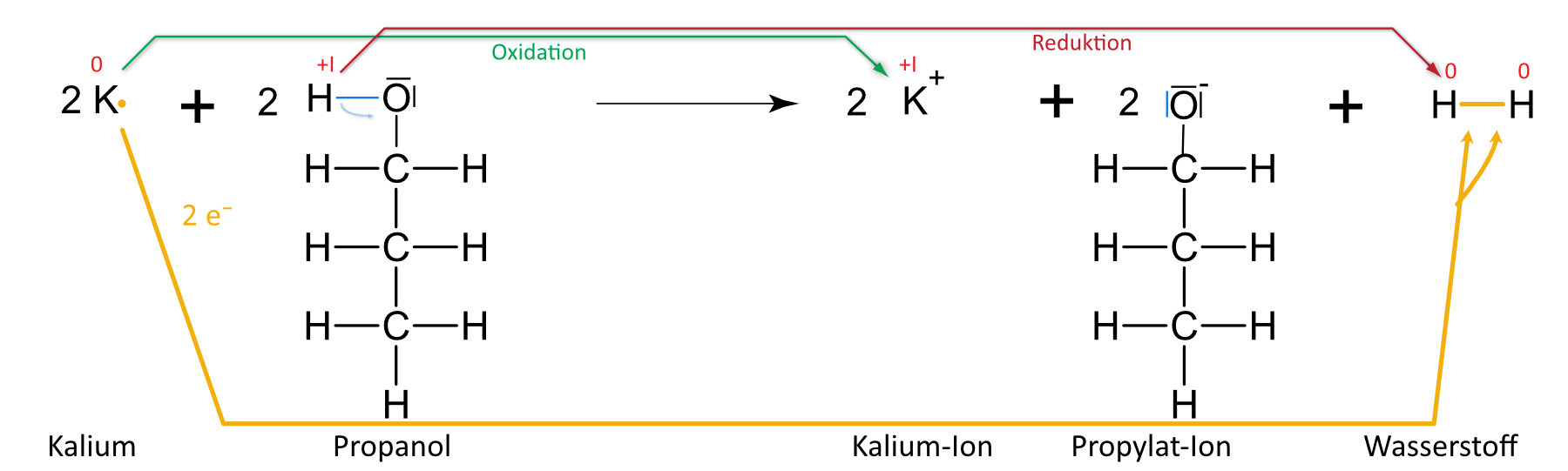
Kalium und Propanol
{slider title="Lösung" open="false" class="icon"}
{/sliders}
- Details
- Geschrieben von: Wolfram Hölzel