2.12 Massenwirkungsgesetz (MWG)
(von Guldberg, Waage (1864))
Die quantitative Abhängigkeit des Gleichgewichts von der Konzentration. (Druck, Temperatur = konstant; homogenes System)
Herleitung: allgemeine Reaktion
A + B ⇌ C + D Δ H ≤ 0
für die Hinreaktionsgeschwindigkeit gilt:
c: Konzentration [mol/Liter]
vHin ∝ c(A) · c(B)
vHin = k1 · c(A) · c(B)
Den Proportionalitätsfaktor k1 bezeichnet man als Geschwindigkeitskonstante der betreffenden Reaktion. Diese Geschwindigkeitskonstante ist von der Temperatur abhängig.
für die Rückreaktionsgeschwindigkeit gilt:
vRück ∝ c(C) · c(D)
vRück = k2 · c(C) · c(D)
Im Gleichgewichtszustand ist die Geschwindigkeit der Hinreaktion gleich der Rückreaktion.
also im GG: vHin = vRück
eingesetzt: k1 · c(A) · c(B) = k2 · c(C) · c(D)
Das Verhältnis k1/k2 ist eine neue Konstante K.
Massenwirkungsgesetz (zunächst in einfacher Form für das oben genannte Beispiel):
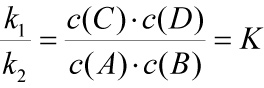
Man schreibt die Reaktionsgleichung i.d.R. so, dass die exotherme Richtung nach rechts verläuft, und stellt die Produkte in den Zähler des MWG.
Das MWG in Worten: Das Produkt der Konzentrationen der entstehenden Stoffe (Endstoffe) dividiert durch das Produkt der Konzentrationen der Ausgangsstoffe besitzt im Gleichgewicht-Zustand einen konstanten Wert K (Gleichgewichtskonstante).
Allerdings ist das Massenwirkungsgesetz nur für dieses Beispiel ( A + B ⇌ C + D) gültig. Wie sieht das MWG aber für eine Reaktion wie 3A + 2B ⇌ C + 5D aus? Dazu zunächst ein Beispiel:
c) Jodwasserstoffgleichgewicht
H2 + I2 ⇌ 2 HI
vHin = k1 • c(H₂) • c(I₂)
vRück = k2 • c(HI) • c(HI) = k2 • c2(HI)
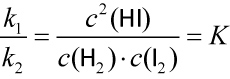
d) Für alle homogene Gleichgewichtsreaktionen kann man das MWG anwenden, auch wenn die Reaktionsgeschwindigkeiten der Hin- und Rückreaktion nicht in so einfacher Weise von den Konzentrationen der Reaktionspartner abhängen wie beim Jodwasserstoffgleichgewicht.
Allgemeine Reaktion:
a A + b B ⇌ c C + d D ΔH < 0
Im Gleichgewichtszustand hat der folgende Quotient bei einer bestimmten Temperatur einen konstanten Wert (Gleichgewichtskonstante Kc).
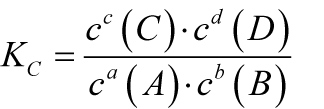
2.13.1 Fallunterscheidung (Lage eines Gleichgewichts)
K > 1: Zähler größer als Nenner; Endstoffe (Produkte) überwiegen; das GG liegt rechts.
K < 1: Zähler kleiner als Nenner; Ausgangsstoffe (Edukte) überwiegen; das GG liegt links.
K = 1: Zähler gleich Nenner; Produkt der Konzentrationen von Ausgangsstoffen und Endstoffen ist gleich; das GG liegt in der Mitte.
