1. Alkane
1.1 Methan
1.2 Ethan
(bei ausreichend Zeit)
1.3 Propan
(bei ausreichend Zeit)
1.4 Butan
1.5 Homologe Reihe der Alkane
1.6 Nomenklatur der Alkane
1.7 Struktur und Eigenschaften der Alkane
1.8 Angriffsfreudige Teilchen
1.9 Reaktion von Alkanen mit Halogenen
- Details
- Geschrieben von: Wolfram Hölzel
1. Alkane
1.1 Methan
1.1.1 Vorkommen:
im Erdgas, Sumpfgas, Biogas, Grubengas
1.1.2 Eigenschaften:
- farb- und geruchloses Gas
- geringere Dichte als Luft
- brennbar
1.1.3 Ermittlung der Summenformel (Molekülformel) und Strukturformel
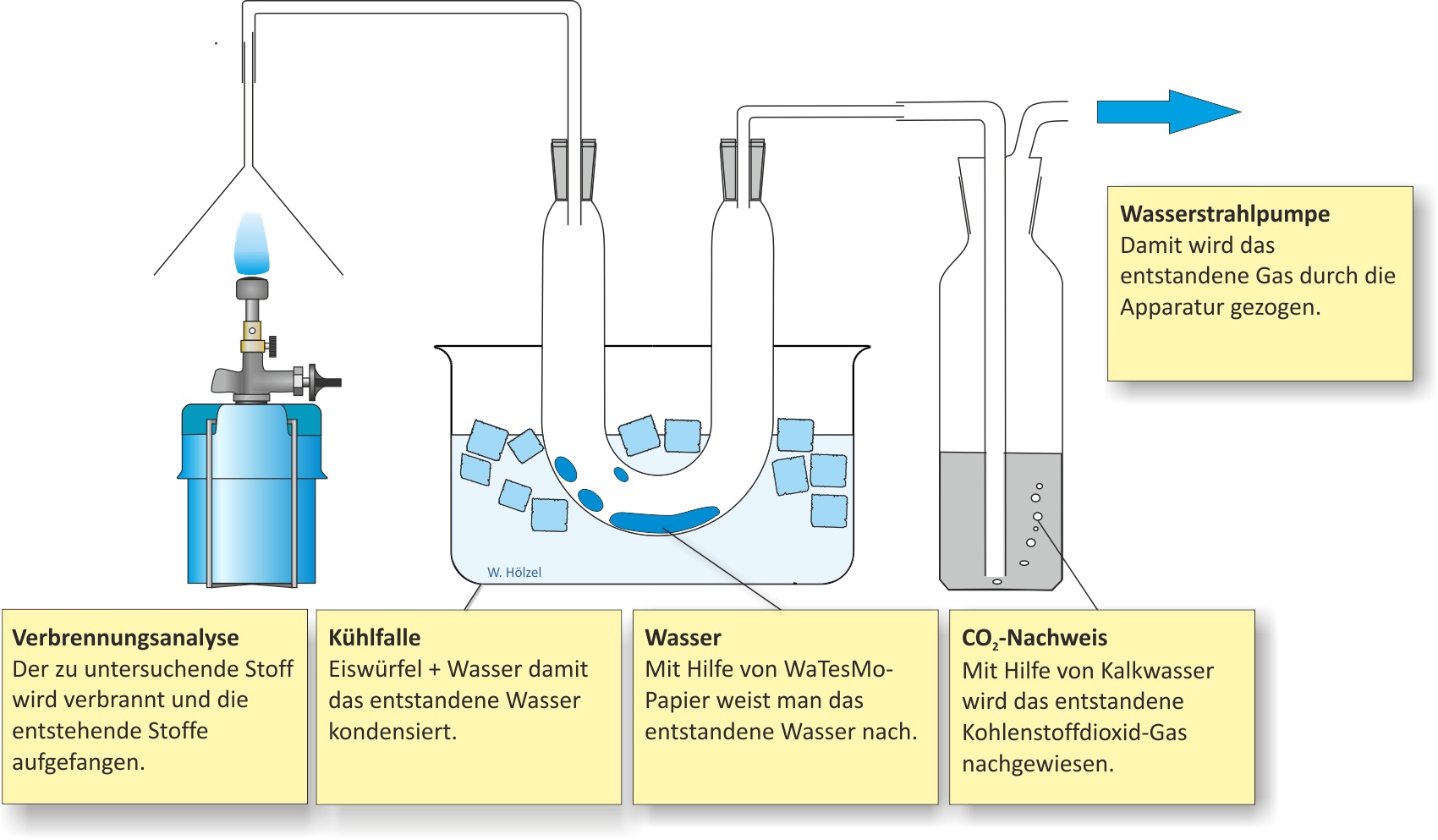
a) Qualitative Analyse (Elementaranalyse)
Hierfür wird der zu untersuchende Stoff verbrannt und die Verbrennungsprodukte werden bestimmt.
Bildet sich Wasser, wird Wasserstoff als Element vorhanden sein;
Kohlenstoff kann man einmal als Ruß (bei unvollständiger Verbrennung) oder als Kohlenstoffdioxid nachweisen. Der Kohlenstoffdioxid-Nachweis erfolgt mit der Kalkwasserprobe. Hierfür wird das entstandene Gas in Kalkwasser eingeleitet. Trübt sich die Lösung, ist Kohlenstoffdioxid vorhanden.
- Nachweis von Wasserstoff → Bildung von Wasser → WaTesMo-Papier oder wasserfreies Kupfersulfat.
- Nachweis von C → Bildung von CO2 → Nachweis als CaCO3.
Ca(OH)2 (aq) + CO2 (g) → CaCO3 (s) + H2O (l)
Die Verbrennungsprodukte (Wasser, Kohlenstoffdioxid) ergeben, dass Methan Kohlenstoff, Wasserstoff und eventuell Sauerstoff enthält
b) Bestimmung der molaren Masse
Mit Hilfe der Gaswägung kann man die Molare Masse von Methan bestimmen: M(Methan) = 16 g/mol
Molekülmasse von Methan 16 u
c) Summenformel:
Daraus ergibt sich folgende Summenformel.
CH4
d) Strukturformel:
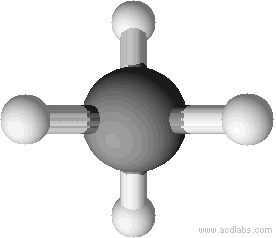
Man zeichnet Methan meist mit einem Winkel von 90°. Dieser Winkel entspricht nicht dem Bindungswinkel (vgl. unten). Man kann sich aber vorstellen, dass man direkt auf das Molekül wie in der zweiten Abbildung dargestellt wird, blickt.
Tetraedrische Anordnung der Wasserstoffatome um das Kohlenstoffatom (Bindungswinkel 109,5 °).
Erklärung: Größtmögliche Entfernung der Wasserstoffatome.
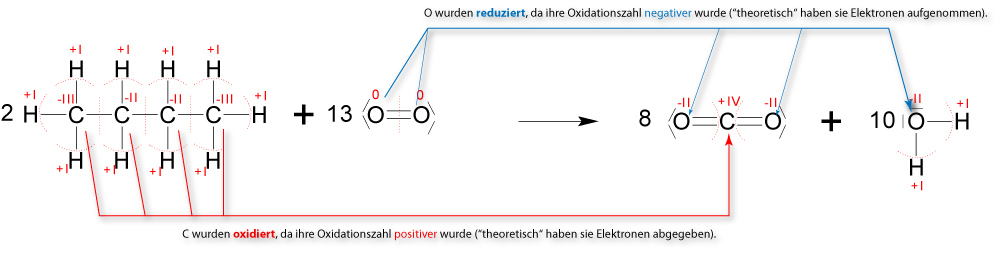
1.1.4 Vollständige Verbrennung:
0 -IV +I +IV -II +I -II
2 O2 + CH4 → CO2 + 2 H2O ΔH = - 888 kJ/mol
Hinweis: Wenn die Ermittlungs der Oxidationszahlen Schwierigkeiten macht, dann kann man es hier nochmals nachlesen.
1l Methan benötigt zur vollständigen Verbrennung 10 Liter Luft (2 l Sauerstoff).
- Details
- Geschrieben von: Wolfram Hölzel
Hinweis: 1.2 Ethan und 1.3 Propan wird nur bei ausreichend Zeit und entsprechend vorrätigen Chemikalien als einzelne Punkte besprochen. Da es aber sowieso ähnlich ist, wird an dieser Stelle auf den Heftaufschrieb verzichtet (vgl. weiter unten: Homologe Reihe).
1.4 Butan
1.4.1 Vorkommen
im Erdgas, fällt an bei der Benzingewinnung
1.4.2 Eigenschaften
farbloses Gas, größere Dichte als Luft
brennbar (Verbrennungsprodukte bei vollständiger Verbrennung: CO2 und H2O )
unter Druck leicht verflüssigbar
1.4.3 Ermittlung der Summenformel (Molekülformel) und Strukturformel
a) Qualitative Analyse (Elementaranalyse)
Die Verbrennungsprodukte (Wasser, Kohlenstoffdioxid) ergeben, dass Methan Kohlenstoff, Wasserstoff und eventuell Sauerstoff enthält
b) Bau und Formeln
1. Molare Masse = 58,12 g/mol
Molekülmasse = 58,12 u
2. Summenformel:
C4H10
3. Strukturformel:
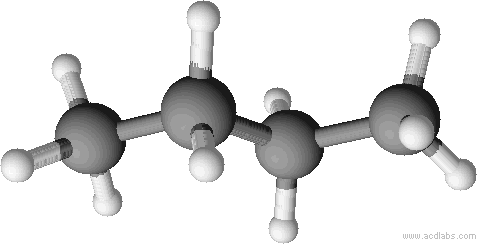
a) unverzweigte Kette b) verzweigte Kette
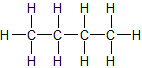
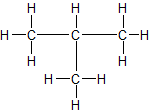
n-Butan Isobutan = 2-Methyl-Propan
Sdp.: - 0,5 °C Sdp.: - 12 °C
ZMK: nur van-der-Waals-Kräfte; bei n-Butan können sich die Moleküle dichter zusammenlagern und haben dadurch stärkere Zwischenmolekulare Kräfte, d.h. eine etwas höhere Siedetemperatur.
Räumliche Strukturen im Kugelstabmodell. Versucht die einzelnen Abbildungen Isobutan oder n-Butan zuzuordnen. Der Vorteil von Kugelstabmodelle sind, dass sie die Bindungen und Bindungswinkel anschaulich darstellen.
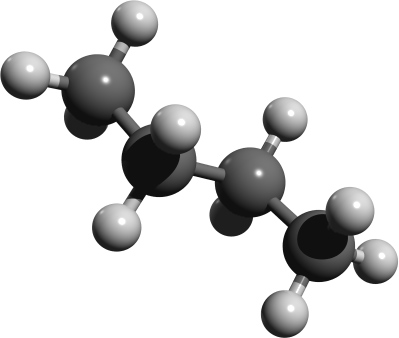
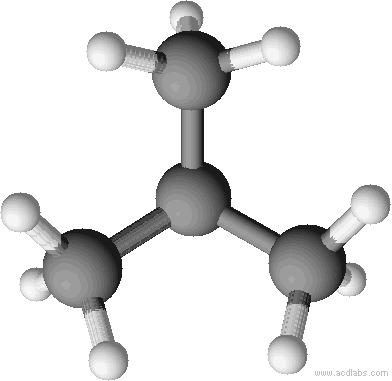
Kalottenmodell von 2-Methyl-Propan (= Isobutan). Bei Kalottenmodellen wird die Raumfüllung deutlich.
Da Strukturformeln bei größeren Molekülen zu lange dauern, hilft man sich mit der Halbstrukturformel aus, wobei die Wasserstoffatome quasi als Summenformel hinter das C geschrieben wird. Man schaut zunächst, wie viele Bindungen ein C schon hat und füllt dann mit so vielen H-Atomen auf, bis die Vierbindigkeit von Kohlenstoff erfüllt ist. Hier am Beispiel von Isobutan.
1.4.4 Verwendung
Heizgas („blaue Gaskartuschen“), Kältemittel (Ersatz für FCKW), Treibgas in Sprays, Feuerzeuggas (häufig zusammen mit Propan)
1.4.5 Isomerie
(isos (griech.) = gleich; meros (griech.) = Teil)
Verbindungen, deren Moleküle bei gleicher Summenformel unterschiedliche Strukturformeln besitzen, bezeichnet man als Isomere. Isomere Verbindungen unterscheiden sich vor allem in ihren physikalischen Eigenschaften (Schmelz- und Siedepunkt) und wenig in ihren chemischen Reaktionen.
1.4.6 Vollständige Verbrennung (Oxidation)
Wenn Butan vollständig verbrannt (oxidiert) wird, so entsteht dabei ausschließlich Kohlenstoffdioxid und Wasser.
- Details
- Geschrieben von: Wolfram Hölzel
1.5 Homologe Reihe der Alkane
( homo = gleich, logos = Stoff)
Allgemeine Summenformel der homologe Reihe
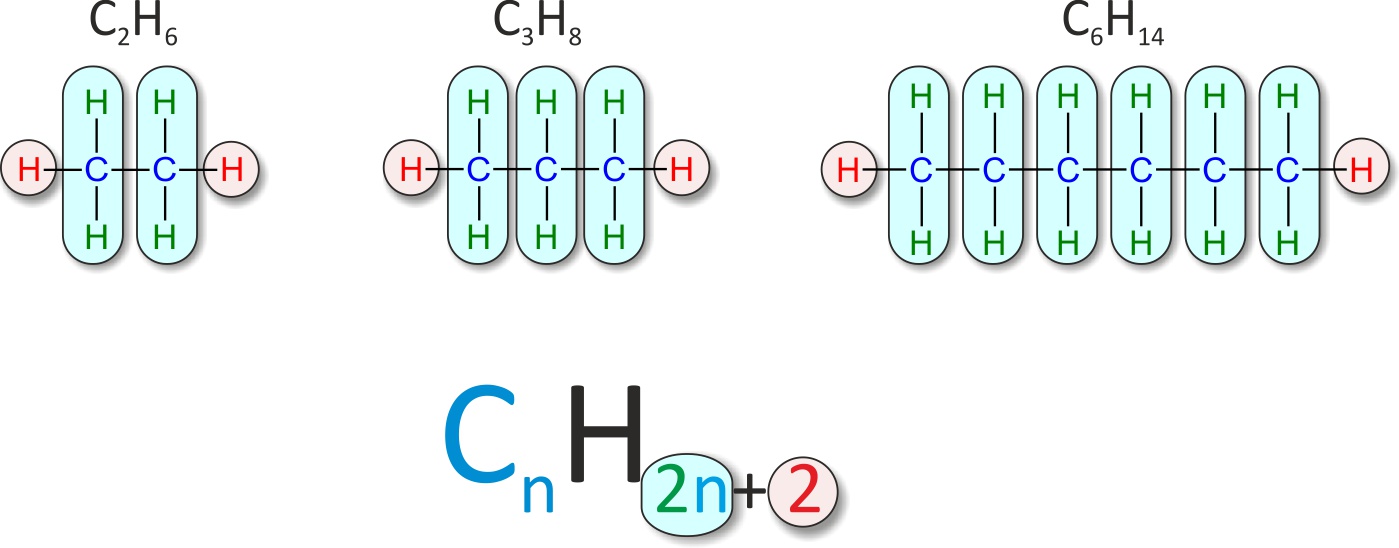
CnH2n+2
wichtigste Eigenschaften:
- brennbar (bei vollständiger Verbrennung entsteht CO2 und H2O)
- Dichte (g/cm³) kleiner als 1
- in Wasser lösen sich die Alkane nicht (evtl. in Spuren), Alkane sind untereinander in jedem Verhältnis mischbar)
Die homologe Reihe
Eine Reihe von organischen Verbindungen, deren aufeinanderfolgende Glieder sich jeweils um eine bestimmte Atomgruppe, z. B. eine CH2- Gruppe unterscheiden, nennt man homologe Reihe.
| Name |
Summen- |
Strukturformel | Halbstrukturformel | Aggregatzustand |
| Methan | CH4 | 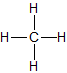 |
CH4 | gasförmig |
| Ethan | C2H6 | 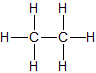 |
CH3-CH3 | gasförmig |
| Propan | C3H8 | 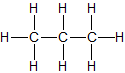 |
CH3-CH2-CH3 | gasförmig |
| n-Butan | C4H10 | 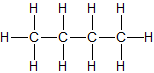 |
CH3-CH2-CH2-CH3 | gasförmig |
| n-Pentan | C5H12 | 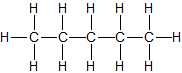 |
CH3-CH2-CH2-CH2-CH3 | flüssig |
| n-Hexan | C6H14 | |
CH3-(CH2)4-CH3 | flüssig |
| n-Heptan | C7H16 | |
CH3-(CH2)5-CH3 | flüssig |
| n-Octan | C8H18 | |
CH3-(CH2)6-CH3 | flüssig |
| n-Nonan | C9H20 | |
CH3-(CH2)7-CH3 | flüssig |
| n-Decan | C10H22 | |
CH3-(CH2)8-CH3 | flüssig |
| n-Undecan | C11H24 | |
CH3-(CH2)9-CH3 | flüssig |
| n-Dodecan | C12H26 | |
CH3-(CH2)10-CH3 | flüssig |
| .... | ||||
| n-Heptadecan | C17H36 | |
CH3-(CH2)15-CH3 | fest |
Eine Reihe von organischen Verbindungen, deren aufeinanderfolgende Glieder sich jeweils um eine bestimmte Atomgruppe, z. B. eine CH2- Gruppe unterscheiden, nennt man homologe Reihe.
- Details
- Geschrieben von: Wolfram Hölzel
1.6 Nomenklatur (Benennung) der Alkane
1.6.1 Homologe Reihe der Alkane mit Alkylrest
Ein Alkylrest enthält jeweils ein Wasserstoff-Atom weniger als das entsprechende Alkanmolekül. Alkyle finden sich oft als "Seitengruppe" verzweigter Alkane.
| Name | Summenformel | Name d. Alklys | Summenformel |
| Methan | CH4 | Methylrest | -CH3 |
| Ethan | C2H6 | Ethylrest | -C2H5 |
| Propan | C3H8 | Propylrest | -C3H7 |
| allg. Alkane | CnH2n+2 | Alkylrest | -CnH2n+1 |
1.6.2 Nomenklaturregel für Alkane (Genfer Nomenklatur):
Als Beispiel soll folgendes Molekül systematisch benannt werden:
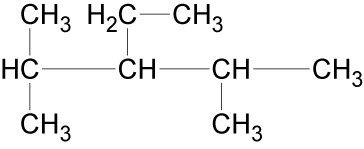
- Alkane haben die Endung -an.
- Der Name des Alkans, das die Hauptkette bildet, liefert den Stammnamen des Stoffs.
Längste Kette der Kohlenstoffkette suchen und „Glattbügeln“.

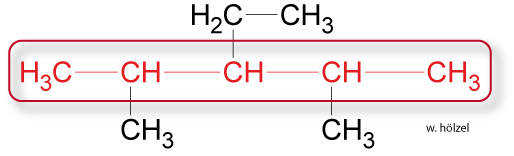
- Beispiel.: Alle Alkane mit 5 Kohlenstoff-Atomen in der längsten Kette heißen Pentan.
- Die Namen der Seitenketten werden dem Stammnamen vorangestellt.
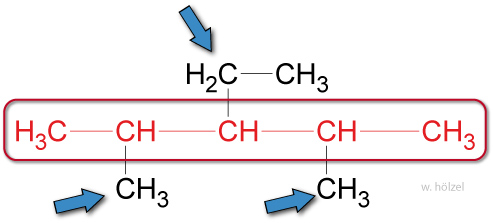
Beispiel: Methyl-Ethyl-Pentan.
- Um anzuzeigen, an welchem Kohlenstoff-Atom die Seitenkette sitzt, wird die Hauptkette nummeriert. Die Verzweigungsstellen sollen dabei möglichst kleine Zahlen erhalten. Die Zahlen werden den Namen der Seitenketten vorangestellt.
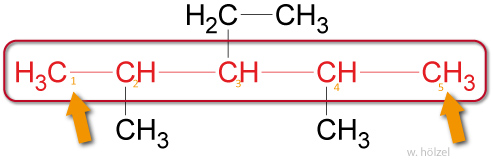
Beispiel: 2,4-Methyl-3-Ethyl-Pentan.
- Treten gleiche Seitenketten mehrfach in einem Molekül auf, so wird das entsprechende Zahl-wort (Di-, Tri-, Tetra-, Penta-) als Vorsilbe verwendet.
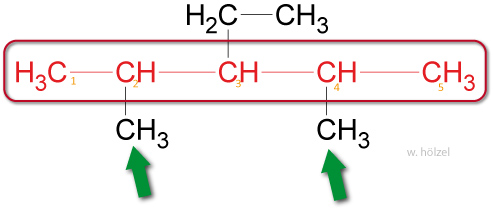
Beispiel: 2,4-Dimethyl-3-Ethyl-Pentan.
- Unterschiedliche Seitenketten werden alphabetisch nach dem Namen der Alkylgruppe geordnet.

Beispiel: 3-Ethyl-2,4-Dimethyl-Pentan.
Folgende Abbildung zeigt ein weiteres Beispiel:
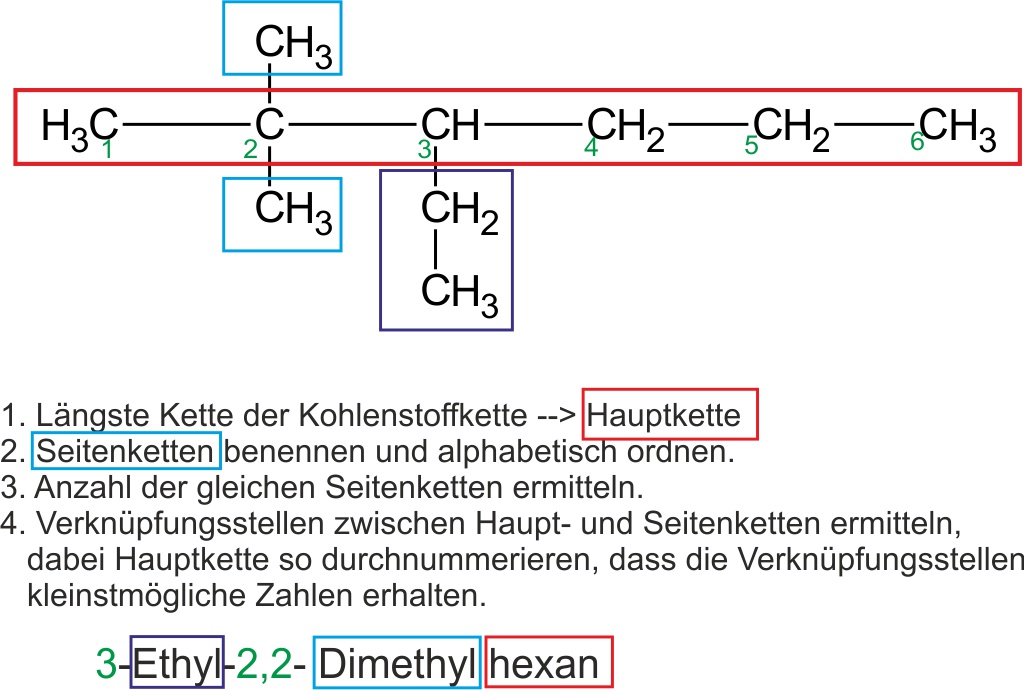
- Details
- Geschrieben von: Wolfram Hölzel