6 Carbonylverbindungen – Alkanale (Aldehyde) und Alkanone (Ketone)
6.1 Alkanale (Aldehyde)
6.1.1 Herstellung
6.1.2 Funktionelle Gruppe der Alkanale (Aldehyde)
6.1.3 Vergleich der Siedetemperaturen
6.1.4 Verwendung von Formaldehyd (Methanal) und Acetaldehyd (Ethanal) (nicht online)
6.1.5 Aldehydnachweise
6.2 Alkanone (Ketone)
6.2.1 Herstellung von Alkanonen (Ketonen)
6.2.2 Funktionelle Gruppe der Alkanone (Ketone)
6.2.3 Eigenschaften und Verwendung von Aceton (Propanon)
6.3 Unterscheidung: Aldehyde – Ketone
6.3.1 Nomenklatur: Aldehyde – Ketone
- Details
- Geschrieben von: Wolfram Hölzel
6 Carbonylverbindungen – Alkanale (Aldehyde) und Alkanone (Ketone)
6.1 Alkanale (Aldehyde)
6.1.1 Herstellung
Die grundsätzliche Reaktion für die Herstellung ist die Oxidation eines Alkohols. Wichtig dafür ist, dass man die Erlenmeyer-Regel verstanden hat.
Experiment (Hinweis: Anders als bei den Übungen angegeben, darf man den Versuch nicht mit allen Alkanole durchführen, weil extrem giftige Stoffe entstehen können!).
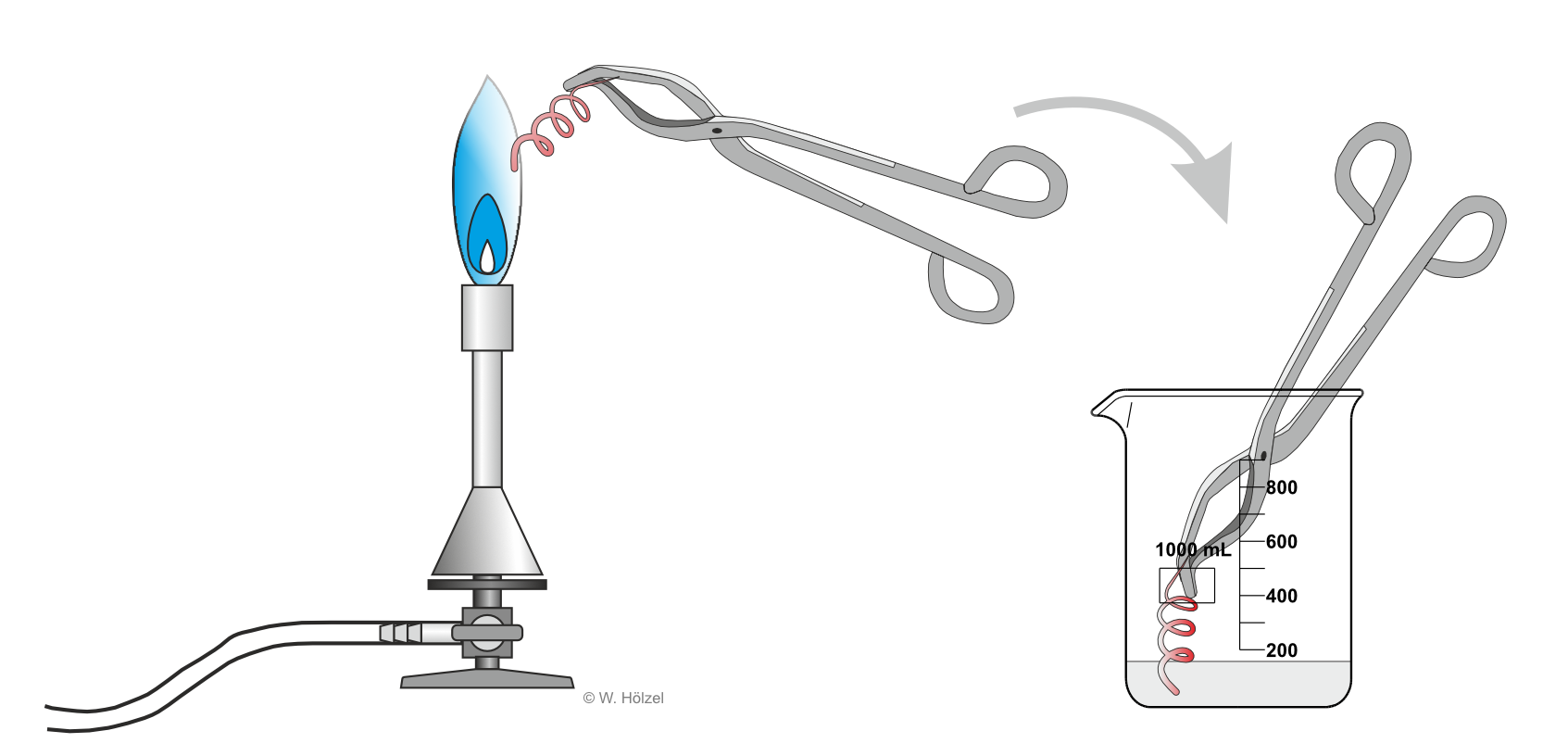
Um einen Alkohol oxidieren zu können, braucht man ein "Oxidationsmittel", also ein Stoff, der andere Stoffe oxidiert. In unserem Schullabor ist das Kupfer(II)-oxid. Dieses Kupfer(II)-oxid stellen wir ganz einfach her, indem wir Kupferblech in einer Teclu-Flamme oxidieren (linke Seite der Abbildung). Dadurch färbt sich das Kupferblech durch das Kupfer(II)-oxid schwarz.
Übung: Formuliere für diesen Vorgang die Reaktionsgleichung (Struktur- und Summenformel), bestimme die Oxidationszahlen und beurteile welche Atome oxidiert und welche reduziert wurden.
{slider title="Lösung" open="false" class="icon"}
{/sliders}
Im nächsten Schritt taucht man noch das heiße, schwarze Kupferblech mit dem Kupfer(II)-oxidschicht in den Alkohol. sofort wird das schwarze Kupfer(II)-oxidblech an den Stellen die in den Alkohol eintauchen blank und kupferfarben. Das Kupfer(II)-Oxid wurd also wieder zu Kupfer reduziert.
Wenn Kupfer reduziert wurde, muss der Alkohol oxidiert werden. In der folgenden Reaktionsgleichung ist das einmal für das Beispiel Methanol dargestellt:
Beispiel Herstellung von Methanal:
I.) Methanol → Methanal
Bei der Reaktion wird Methanol so oxidiert, dass als man sich vorstellen kann, wie zwei Hydroxy-Gruppen an einem C-Atom gebunden werden (Abbildung in der "Wolke"). Dafür wurde zwischen C und H ein Sauerstoff gebunden. Laut Erlenmeyer-Regel geht das aber nicht. Im nächsten Schritt muss also Wasser abgespalten werden und es bildet sich eine Carbonyl-Gruppe, nämlich das Methanal.
Versucht bitte einmal diese Schritte nachzuvollziehen, ich habe sie farbig auch hervorgehoben.
Nun seid ihr dran: Formuliert für die Bildung von Ethanal (aus Ethanol) und Propanal (aus Propanol) auch die Reaktionsgleichungen wie oben.
II) Ethanol → Ethanal
Formuliert für die Bildung von Ethanal aus Ethanol die Reaktionsgleichung mit freien und bindenden Elektronenpaaren.
{slider title="Lösung" open="false" class="icon"}
{/sliders}
III) Propanol → Propanal
Formuliert für die Bildung von Propanal aus Propanol die Reaktionsgleichung mit freien und bindenden Elektronenpaaren.
{slider title="Lösung" open="false" class="icon"}
{/sliders}
Wichtig: Alle primären Alkohole lassen sich durch Oxidation (bzw. Dehydrierung) in Aldehyde (Alkanale) überführen.
- Details
- Geschrieben von: Wolfram Hölzel
6.1.2 Funktionelle Gruppe der Alkanale (Aldehyde)
= Aldehydgruppe (= Sonderfall einer Carbonylgruppe)
6.1.3 Vergleich der Siedetemperaturen
Versucht einmal die folgende Tabelle zu vervollständigen.
| Methan | Methanal | Methanol | |
| Strukturformel | |||
| Molare Masse (M) in g/mol | |||
| Siedetemperatur | - 164 °C | - 21 °C | +64,5 °C |
| Begründung für die Siedetemperatur mit Hilfe der ... |
{slider title="Lösung" open="false" class="icon"}
| Methan | Methanal | Methanol | |
| Strukturformel | 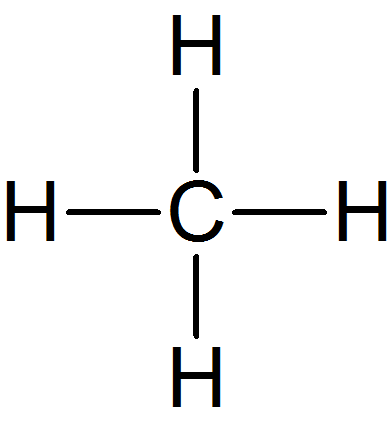 |
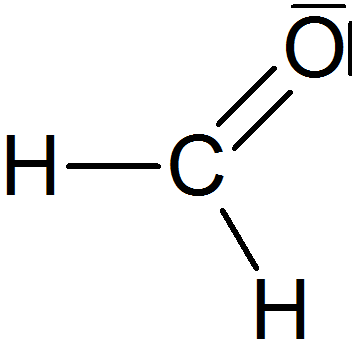 |
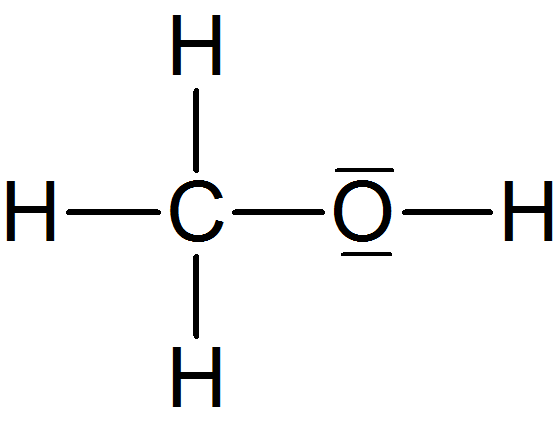 |
| Molare Masse (M) in g/mol | 16 g/mol | 30 g/mol | 32 g/mol |
| Siedetemperatur | - 164 °C | - 21 °C | +64,5 °C |
| Begründung für die Siedetemperatur mittels ZMK |
{/sliders}
- Details
- Geschrieben von: Wolfram Hölzel
6.1.4 Aldehydnachweise
a) Schiffsche-Probe mit Fuchsinschwefliger Säure
Fuchsinschweflige Säure ergibt mit Aldehyden eine rotviolette Farbe. Dieser Aldehydnachweis beruht nicht auf der Reduktionswirkung von Aldehyden!
b) Tollens-Probe (Silberspiegel)
Versuchsaufbau (gilt auch für Fehling-Probe)
Versuchsdurchführung:
Schutzbrille aufsetzen, weite Ärmel hochkrempeln, Haare zurückbinden.
- Gib in das RG etwa zwei fingerbreit Silbernitratlösung.
- Füge mit der Pipette tropfenweise verdünnte Ammoniaklösung hinzu, bis sich der entstehende Niederschlag gerade wieder auflöst.
- Gib nun in das RG zwei fingerbreit Probelösung.
- Stelle das RG in das heiße Wasserbad.
Beobachtung:
Es bildet sich ein Silberspiegel auf der Innenseite des Reagenzglas.
Auswertung:
Es bedeutet, dass sich die Silber-Ionen zu elementarem Silber reduziert haben. Da eine Reduktion nur zusammen mit einer Oxidation ablaufen, muss etwas anderes oxidiert worden sein. Da es ein Aldehyd-Nachweis ist, kann man davon ausgehen, dass das C-Atom der Aldehyd-Gruppe oxidiert wurde. Da diese Reaktion in alkalischer Lösung abläuft (Ammoniak wurde dazugegeben), formuliert man mit Hilfe von Hydroxid-Ionen (OH⁻).
c) Fehling-Reagenz
Versuchsdurchführung:
Schutzbrille aufsetzen, weite Ärmel hochkrempeln, Haare zurückbinden.
- Gib in das RG etwa 5 ml Fehling 1-Lösung und dann 5 ml Fehling 2-Lösung.
- Füge ein Spatellöffel Glucose zu.
- Stelle das RG nach kurzem Schütteln in das heiße Wasserbad.
Beobachtung:
Es bildet sich ein roter Niederschlag von Kupfer(I)-Oxid (Cu₂O).
Auswertung:
Diese Reaktion verläuft recht analog zum Silberspiegel (Tollens-Reagens). Nur wird hierbei das Metall-Ion nicht komplett reduziert, sondern das Cu²⁺ wird zu Cu¹⁺ reduziert, wobei es sich sofort mit einem Oxid-Ion verbindet und den rötlichen Niederschlag bildet. Sauerstofflieferant ist auch in diesem Fall wie bei Tollens-Probe das Hydroxid-Ionen, da eine alkalische Lösung vorliegt.
Aufgabe: Versucht mit Hilfe der oberen Gleichung jetzt die Reaktionsgleichungen für das Fehlingreagenz zu formulieren.
{slider title="Lösung" open="false" class="icon"}
{/sliders}
- Details
- Geschrieben von: Wolfram Hölzel
6.2 Alkanone (Ketone)
6.2.1 Herstellung von Alkanonen (Ketonen)
Versuch
Die heiße CuO-Spirale wird mehrmals in 2-Propanol getaucht.
Beobachtung
Der schwarze Überzug verschwindet; es entsteht blankes Kupfer. Zusätzlich tritt ein charakteristischer Geruch auf.
Zugabe von FSS zur abgekühlten Lösung gibt keine Violettfärbung.
Auswertung
Es handelt sich um eine Redoxreaktion. Die Cu²⁺-Ionen werden zu Kupfer reduziert und 2-Propanol (Isopropanol) wir zu Propanon (Aceton) oxidiert.
Reaktionsgleichung
Versucht einmal für diese Herstellung die Reaktionsgleichung mit Hilfe von Strukturformeln zu formulieren. Wer Hilfen braucht, kann ja ein paar Seiten vorher schauen, wo die primären Alkohole oxidiert wurden.
{slider title="Lösung" open="false" class="icon"}
{/sliders}
Merke: Alle sekundären Alkohole lassen sich durch Oxidation (bzw. Dehydrierung) in Ketone (Alkanone) überführen.
6.2.2 Funktionelle Gruppe der Alkanone (Ketone)
Die Alkanone besitzen (auch) eine „Carbonyl-Gruppe“.
Speziell hier: „Keto-Gruppe“
6.2.3 Eigenschaften und Verwendung von Aceton (Propanon)
Aceton ist eine farblose, charakteristisch riechende Flüssigkeit (Sdp.: 56 °C). Aceton ist brennbar. Aceton löst sowohl hydrophile (z.B. H₂O, C₂H₅OH ⇨ kann mit diesen Molekülen auch H-Brücken eingehen) als auch hydrophobe Stoffe. ⇨ Verwendung: Lösungsmittel.
Erkennbar, dass Aceton ein gutes Lösungsmittel ist, zeigt die nächste Abbildung. Was dort rot gefärbt ist, zeigt näherungsweise die negative Partialladung (anders als bei meiner Farbgebung) umd den Stauerstoff und was blau gefärbt ist, die positive Partialladung.
- Details
- Geschrieben von: Wolfram Hölzel