Energetische Betrachtungen bei chemischen Reaktionen
2 H₂ + O₂ → 2 H₂O + unterschiedliche Formen v. Energie
1 Systeme
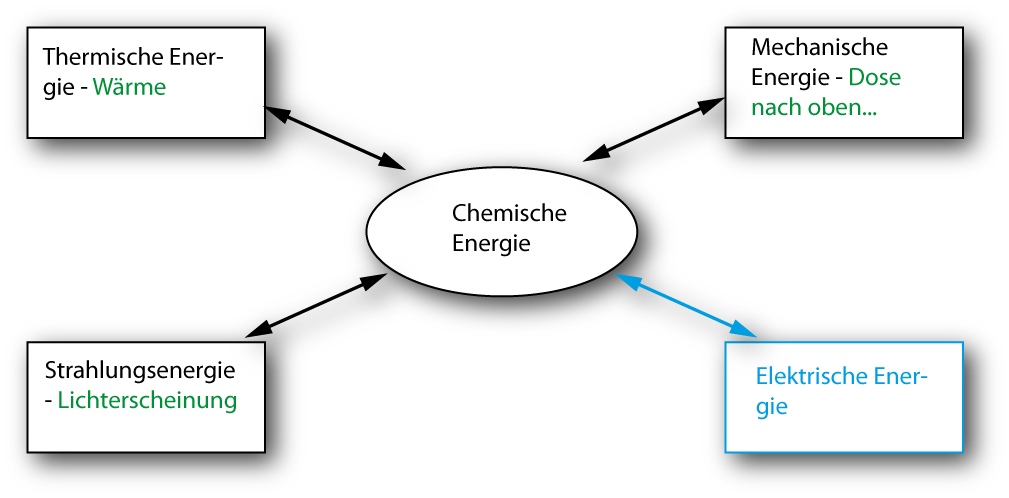
Einen begrenzten Ausschnitt des Universums nennt man ein Systeme¹, den verbleibenden Rest Umgebung.
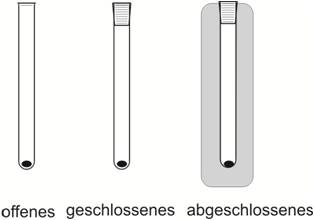
| offenes System | geschlossenes System |
abgeschlossenes (isoliertes) |
|
| Austausch von: |
+ Energie |
+ Energie | --- |
| Kein Austausch von: | --- | - Teilchen | - Energie - Teilchen |
| → Gesamtenergie ist konstant | |||
 |
|||
| idealisierte Beispiele | "Kochtopf" | "Dampfkochtopf" | "Thermoskanne" |
------------------
¹ System (v. griech. systema, „das Gebilde, Zusammengestellte, Verbundene“)
- Details
- Geschrieben von: Wolfram Hölzel
2 Energieerhaltungssatz (Energieprinzip)
Er besagt, dass in einem abgeschlossenen (isolierten) System die Summe der Energien konstant ist. (von Mayer, Joule, Helmholtz)
1. Hauptsatz der Thermodynamik:
Es kann bei keinem physikalischen und chemischen Vorgang Energie neu entstehen oder vergehen, nur die Form der Energie (z.B. mechanische, thermische, elektrische, chemische,...) kann sich ändern.
- Details
- Geschrieben von: Wolfram Hölzel
3 Innere Energie – U
Jeder Stoff hat in sich Energie in irgendeiner Form gespeichert = Innere Energie U,
äußere Energie = potenzielle Energie (wie z.B. Eisenblock auf dem Schrank) + kinetische Energie (z.B. der Eisenblock fliegt runter) ⇨ spielt keine Rolle für chemische Reaktionen.
Man unterscheidet vereinfacht:
- den physikalisch-thermischen (Bsp.: Rotationsenergie, Schwingungsenergie), Uth
- den chemischen (die potentielle Energie der Bindungskräfte bzw. die Bindungsenergie) Uch und
- den kernphysikalischen (potentielle Energie, die in den Atomkernen vorhanden) UK
.....Anteil der inneren Energie (U = UK + Uch + Uth)
Es lässt sich kein Absolutbetrag U stofflicher Systeme angeben, da sich kein Energienullpunkt festlegen lässt. Bestimmbar sind nur Änderungen der inneren Energie ΔU
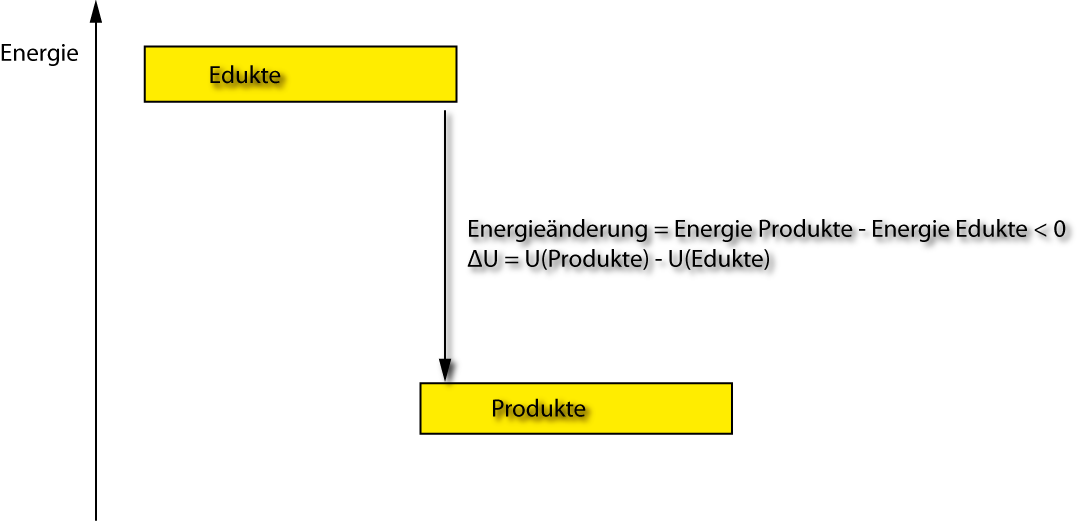
ΔU = U₂ – U₁
ΔU > 0 : Energie wird aufgenommen
ΔU < 0 : Energie wird abgegeben
U₂: Summe der inneren Energien der Produkte
U₁: Summe der inneren Energien der Reaktanden (Edukte)
Änderung der inneren Energie = Wärme + Arbeit
ΔU = U₂ – U₁ = Q + W
Innere Energie = Zustandsgröße
Zustandsgrößen: in einem bestimmten Zustand hat die Zustandsgröße einen bestimmten Wert. Dabei ist es egal, wie man diesen Zustand erreicht hat, also welchen Weg dafür beschritten hat.
Bsp.: Für die momentane potentielle Energie einer Person auf einem Berggipfel (Zustandsgröße) ist es gleichgültig, auf welchem Weg die Person den Gipfel erreicht hat. Die aufgewendete Arbeit hingegen, die die Person aufbringen muss, um diese potentielle Energie zu erreichen, hängt natürlich vom zurückgelegten Weg ab.
Zustandsgrößen: Volumen, Druck, Temperatur sind unabhängig von der Vorgeschichte des Systems (ob es vorher 50°C oder 20°C war).
Die Arbeit ist bei chemischen Reaktionen meistens Volumenarbeit.
- Details
- Geschrieben von: Wolfram Hölzel
4 Volumenarbeit - W
Def.:
- isobar = gleicher Druck [gr. isos = gleich; barys = schwer]
- isotherm = gleiche Temperatur;
- isochor = gleiches Volumen
Volumenänderung bei konstanten Druck (= isobar : p = const.):
ΔV = V₂ – V₁
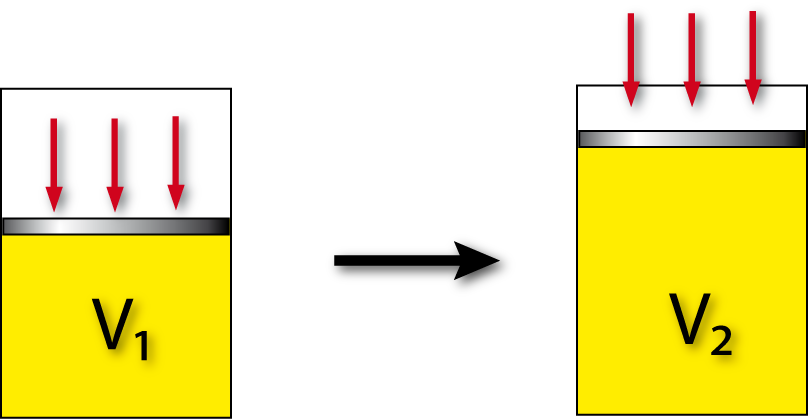
Ein externer Druck übt eine der Ausdehnung entgegengesetzte Kraft aus. Für uns ist das i.d.R. der Atmosphärendruck (= Konstant) (für ein sich ändernder Außendruck = reversibler Vorgang ist dann die UNI zuständig).
Ist der externe Druck 0 (= Vakuum), wir keine Arbeit verrichtet!
Allgemein:
Vom System abgegebene Energie ⇨ negatives Vorzeichen
Da bei Volumenvergrößerung V₂ – V₁ > 0 vom System Volumenarbeit an die Umgebung abgeführt wird, wird die Volumenarbeit mit einem negativen Vorzeichen definiert.
W = Wmech = - p • ΔV
Bei Volumenabnahme wird dem System Volumenarbeit zugeführt (von der Umgebung)
Herleitung:
Querschnitt des Kolbens: A
Von außen auf den Kolben wirkende Kraft: F = A · p
Wenn der Kolben um eine Wegstrecke s nach außen geschoben wird: ΔV = V₂ – V₁ = A ∙ s
Geleistete Arbeit = Kraft x Strecke = Fläche x Druck x Strecke = Fläche x Strecke x Druck = Volumenänderung x Druck
W = F ∙ s = A ∙ p ∙ s = ΔV ∙ p
ΔU = Q – p ∙ ΔV
Gegendruck = Atmosphärendruck:
101325 Pa = 1013,25 hPa (Hektopascal) = 1,01325 bar = 1013,25 mbar
(= Normalbedingung (T = 0°C); = Standardbedingung (T=25 °C))
1 atm = 1,01325 • 10⁵ Pa = 101 325 Pa
SI-Einheiten:
Druck: 1 Pa (=1 kg/(m•s²) = 1 N/m²)
- Details
- Geschrieben von: Wolfram Hölzel
5 Reaktionswärme – Q
Bestimmung der Reaktionswärme – Q.
Bsp: Quantitative Umsetzung von Zink (n(Zn) = 1mol, M(Zn) = 65,4 g/mol) anfällt.
Bildung eines gasförmigen Reaktionsproduktes
- bei konstantem Volumen = Hahn geschlossen
- bei konstantem Druck = Hahn geöffnet
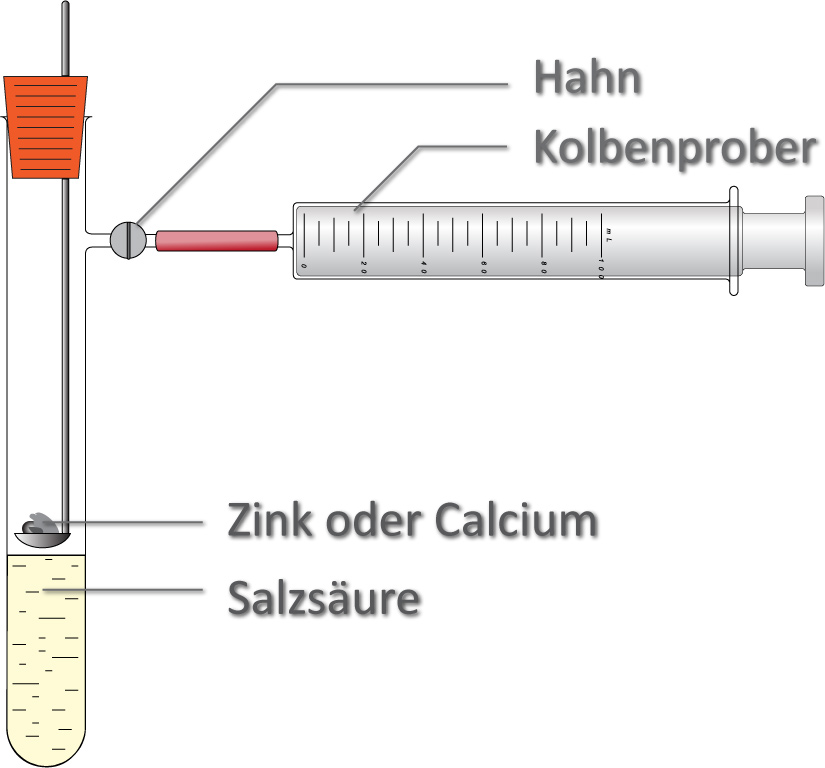
Teilchengleichung:
Zn + 2 H₃O⁺ (aq) + 2 Cl⁻ (aq) → Zn²⁺ (aq) + 2 Cl⁻ (aq) + 2 H₂O + H₂
Freigesetze Reaktionswärme:
bei konstantem Volumen: QV = -156,5 kJ/mol = ΔU
Änderung der Inneren Energie = Reaktionswärme + Volumenarbeit
ΔU = QV + W
ΔU = QV - p ∙ ΔV
QV = Δ U + p ∙ 0
QV = Δ U
bei konstantem Druck: Qp = - 154,0 kJ/mol = ΔH
Bei konstanten Druck gilt:
ΔU = Qp + W
Δ U = Qp – p ∙ Δ V Umstellen nach Q
Qp = Δ U + p ∙ Δ V (= Qp = [U₂ + p ∙ V₂] – [U₁ + p ∙ V₁] )
Enthalpie H ist die spezielle Wärmeenergie bei konstantem Druck
(H von „heat“; Enthalpie: griech: En = darin; thalpos = Wärme)
Definition der Enthalpie: H = U + p ∙ V
→ Qp = H₂ – H₁ = ΔH
Prozessgrößen: Sind vom Weg abhängig (Bsp. Arbeit und Wärme) ⇨ unterschiedliche Werte, je nachdem ob man isobar oder isochor arbeitet.
a) Offene Systeme
- die meisten chemische Reaktionen
- Volumenarbeit
- nicht alles fällt als Wärmeenergie an:
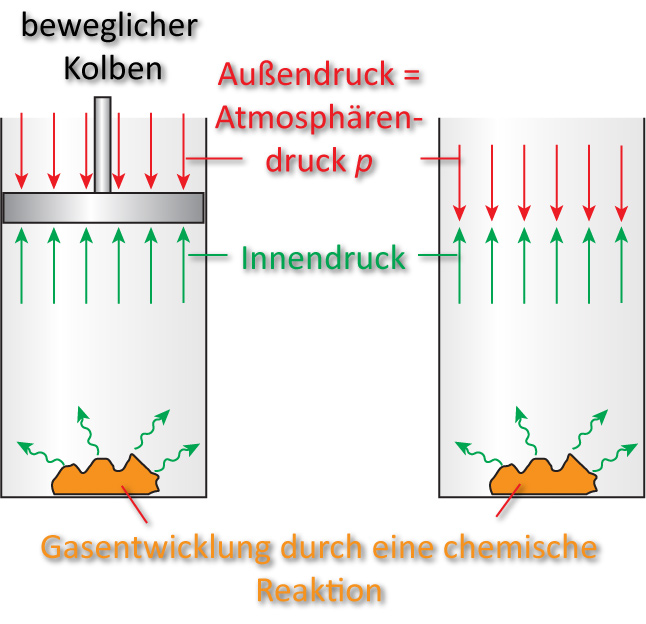
Das entstehende Gas leistet mech. Arbeit gegen den Atmosphärendruck. Die gleiche Arbeit wird auch geleistet, wenn der Kolben fehlt (Außenluft wird verdrängt).
Die Arbeit des Kolbens beträgt: p ∙ Δ V = Volumenarbeit
Änderung Reaktionsenthalpie = Änderung Reaktionsenergie + Volumenarbeit
Δ H = Δ U + p ∙ ΔV
Beispiel:
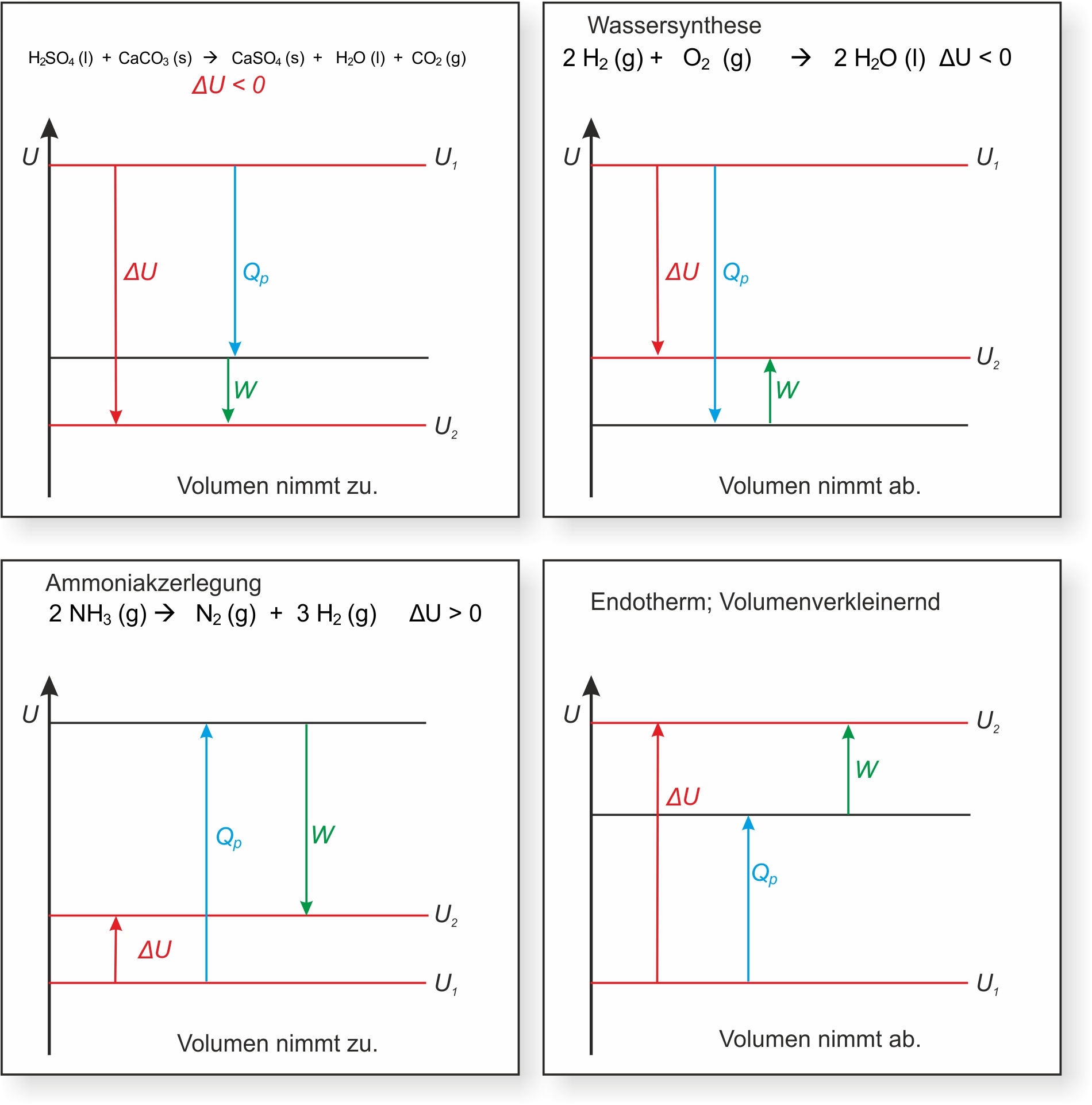
H₂SO₄ (l) + CaCO₃ (s) → CaSO₄ (s) + H₂O (l) + CO₂ (g)
Vm (CO₂) = 24,5 L/mol (bei 25 °C und 101,3 kPa = 101 300 N/m²);
ΔU = - 96,1 kJ/mol
Bei der Reaktion von 1 mol Schwefelsäure:
p ∙ ΔV = 101 ∙ 10³ N/m² ∙ 24,5 ∙ 10-3 m³/mol
= 2,5 ∙ 10³ J/mol ( J = N ∙ m )
= 2,5 kJ/mol
ΔH = Δ U + p ∙ ΔV
= - 96,1 kJ/mol + 2,5 kJ/mol
= - 93,6 kJ/mol
b) Geschlossene Systeme
• keine mechanische Arbeit ⇨ Δ V = 0
• Die bei einer chemischen Reaktion gesamte freigesetzte Energie kann als Wärmeenergie anfallen (Ausnahme: z.B. Lichtenergie)
• Gesamtenergie = Reaktionsenergie ΔU (vgl. oben)
Δ Q = Δ U + p ∙ 0
Δ Q = Δ U
Merke: Die Energiemenge, die ein System bei konstantem Druck als Wärme an die Umgebung abgibt oder von ihr aufnimmt, wird Reaktionsenthalpie ΔH genannt.
Beispiele für chemische Reaktionen mit Volumenarbeit:
- Details
- Geschrieben von: Wolfram Hölzel
