4.4 Polare und unpolare Atombindung
Auch dafür gibt es eine mehr interaktive Seite:
{slider title="Link zur interaktiven Übungsseite mit Bildern" open="false" class="icon"}
{/sliders}
4.4.1 Unpolare Atombindung
Bei der unpolaren Atombindung werden die Bindungselektronen von beiden Atomen gleich oder nahezu gleich angezogen. Bsp.: O₂, Cl₂, etc.
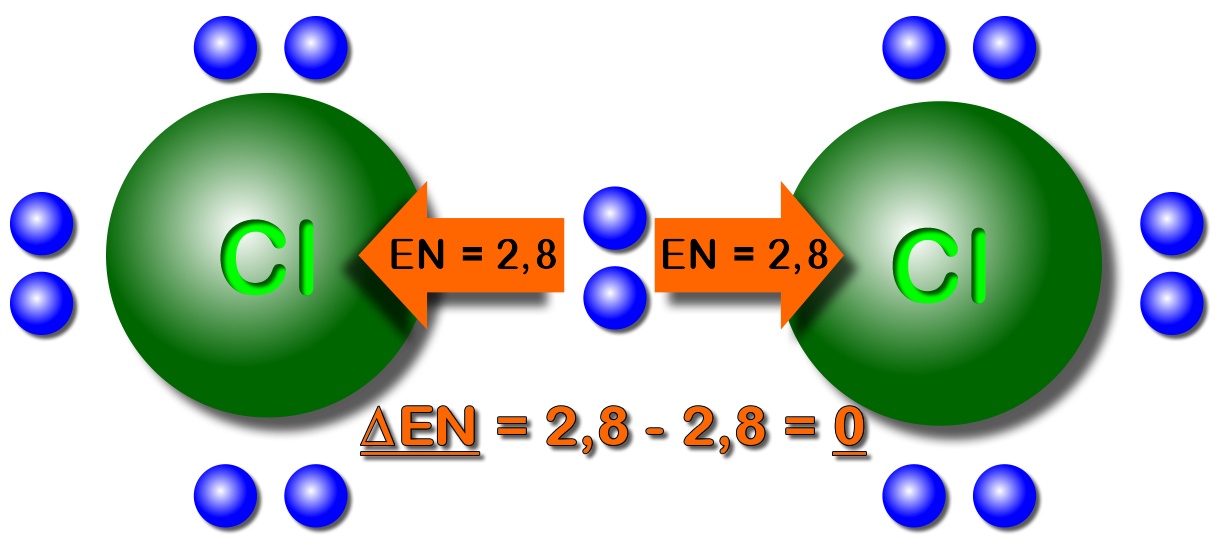
Am Beispiel vom Chlor-Molekül etwas erklärt.
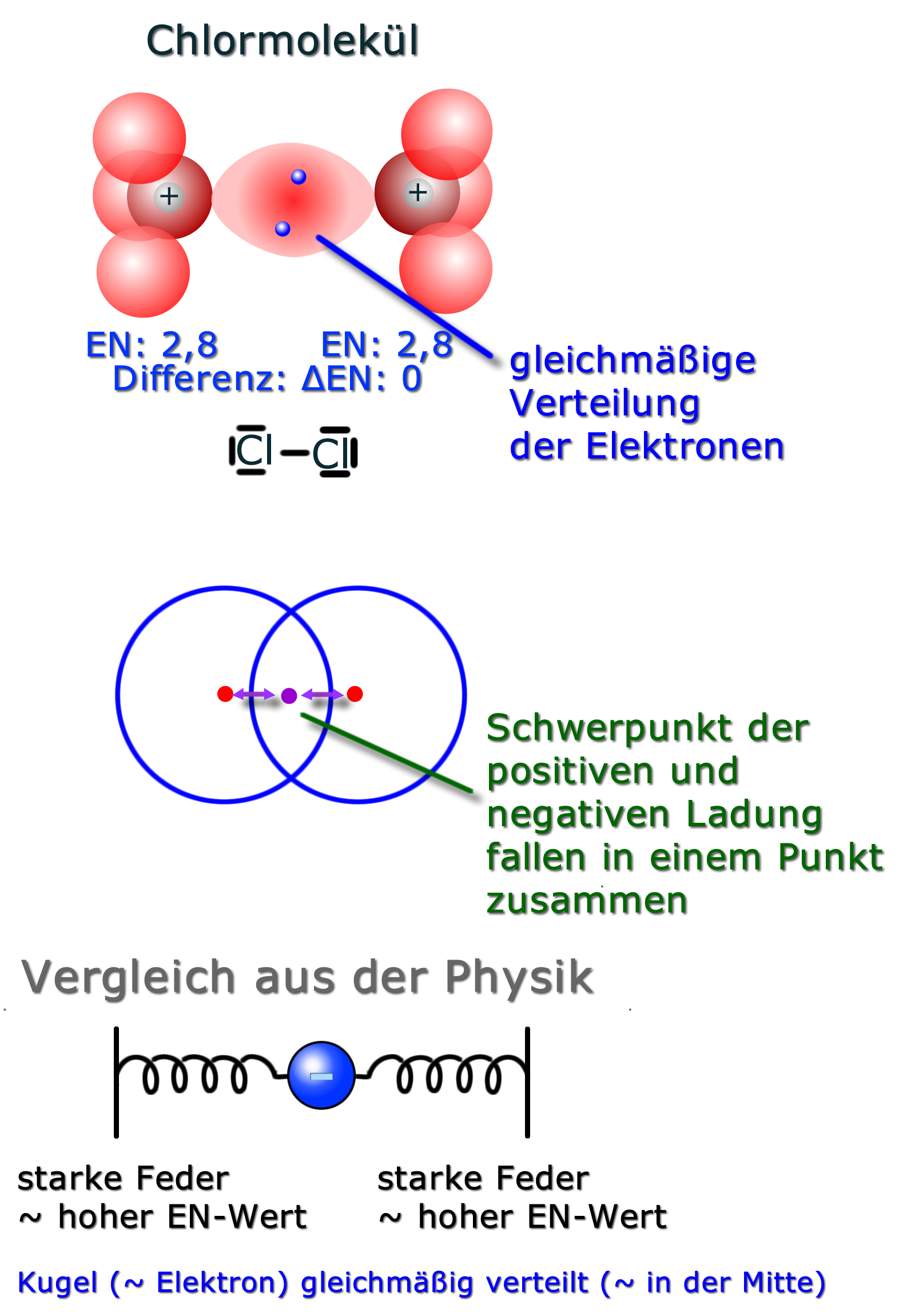
Da beide Chlor-Atome die gleiche Elektronegativität ("Geilheit nach Elektronen") haben, ziehen sie gleich stark. Die Elektronen sind somit in der "Mitte" der beiden Atomkerne. Die Elektronegativitätdifferenz ist 0 ("Null").
Veranschaulichen kann man die Elektronenverteilung mit Hilfe der Federn aus der Physik. Wenn eine Kugel mit gleichstarken Federn befestigt wurde, so ist die Kugel genau in der Mitte. Auch wenn ich die Kugel z.B. nach rechts verschiebe, wird sie sich wieder in die Mitte einpendeln.
| Wichtige Faustregel: Bei einer Elektronegativitätsdifferenz (ΔEN) von 0 bis etwa 0,4 spricht man von einer unpolaren Atombindung. |
4.4.2 Polare Atombindung
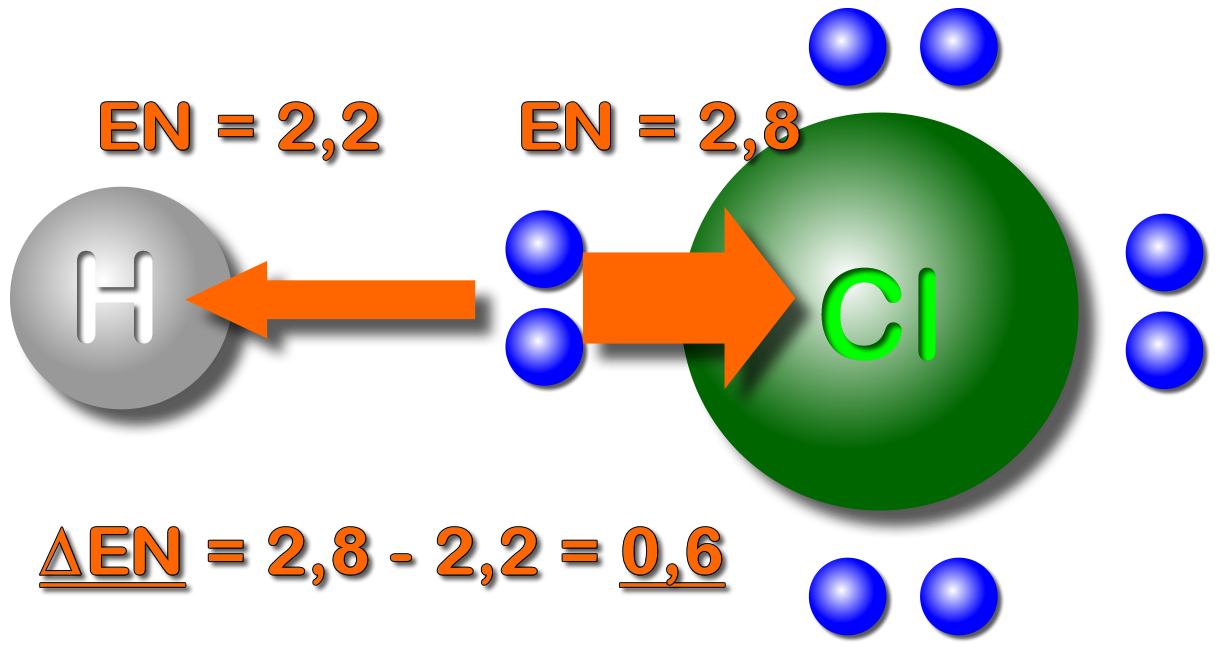
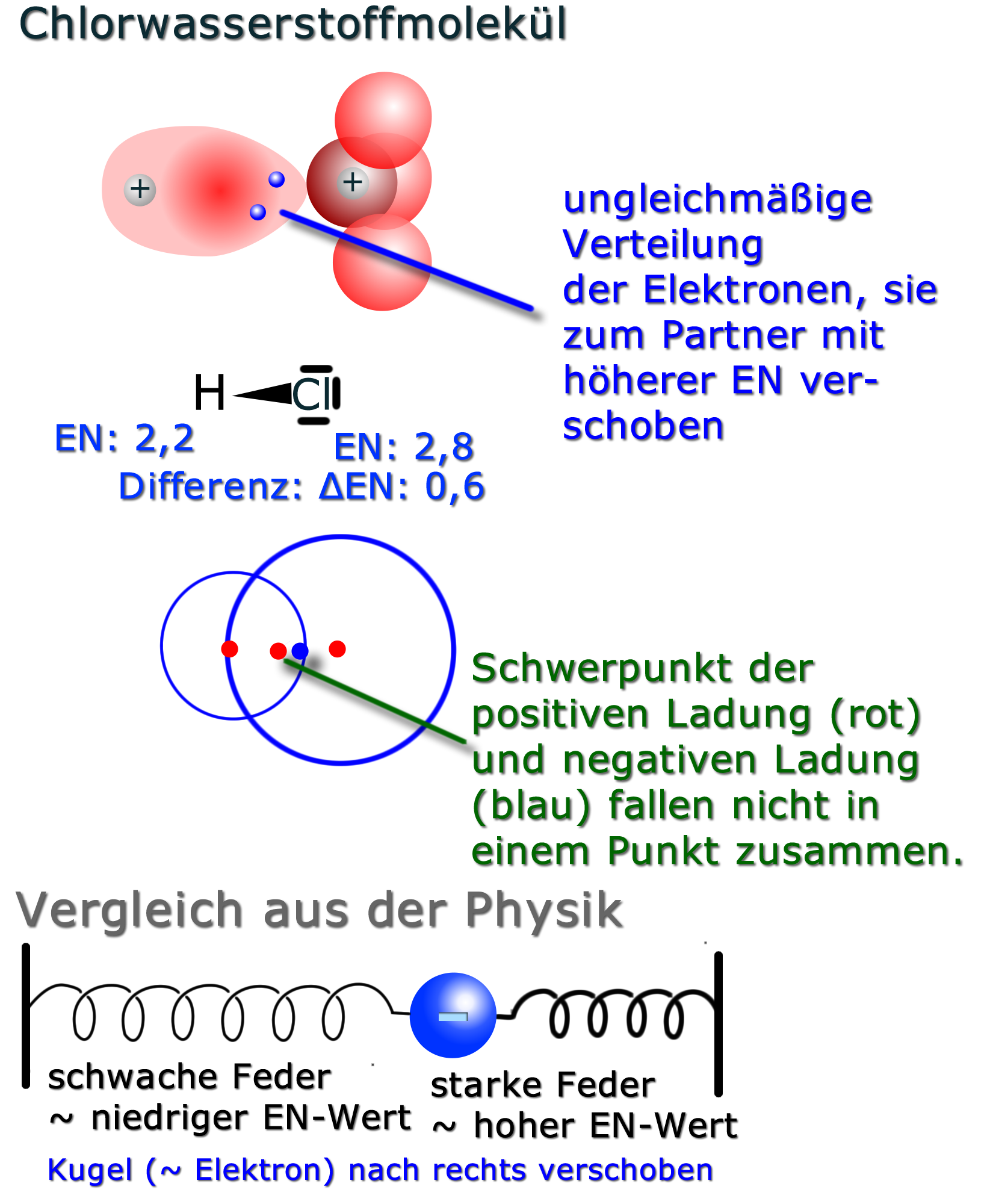
Bei der polaren Bindung werden die Bindungselektronen von einem Atom stärker angezogen als von dem anderen. Dadurch ist die Elektronenwolke zum Atom mit der höheren EN verschoben.
Durch die asymmetrische Verteilung der Elektronen kommt es zu Teilladungen.
Man kennzeichnet die Ladungsverschiebung mit den Symbolen für Teilladungen δ+ und δ- („delta plus bzw. delta minus“) und/oder mit der Keilschreibweise: Hierbei macht man die Seite der Atombindung "dicker", die "mehr" Elektronen hat (bzw. wohin die Elektronen verschoben sind).
Vom gleichen Molekül hier noch ein paar weitere Erklärung mit Hilfe unterschiedlicher Abbildungen:
Auch hier kann der Vergleich aus der Physik bei der Vorstellung helfen. Hierbei ist die Kugel in Richtung der stärkeren Feder verschoben.
| Wichtige Faustregel: Bei einer Elektronegativitätsdifferenz (ΔEN) von etwa 0,4 bis etwa 1,8 spricht man von einer polaren Atombindung. |