Redoxreaktionen
1. Bildung von Ionenverbindungen bei Hauptgruppenelementen
1.1 Magnesium + Sauerstoff
Experiment: Magnesiumband wird an der Luft entzündet. Es brennt mit sehr heller Flamme.
a) Vereinfacht: Alle Elemente als Atome geschrieben.
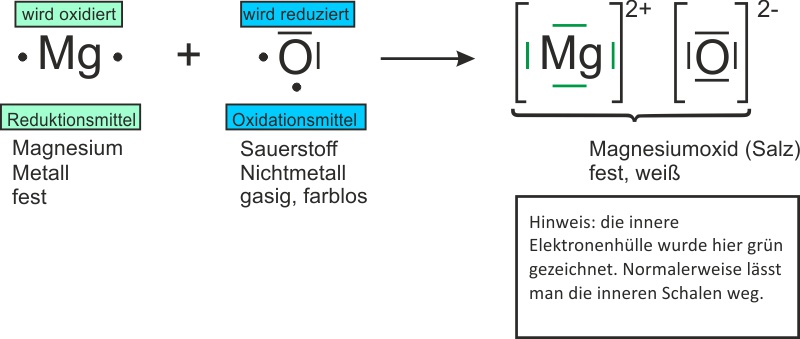
b) keine Vereinfachung: Sauerstoff wird als Molekül geschrieben:
Reaktionsgleichung: 2 Mg + O2 → 2 MgO ΔH < 0
c) Redoxschema:
I. Allgemein:
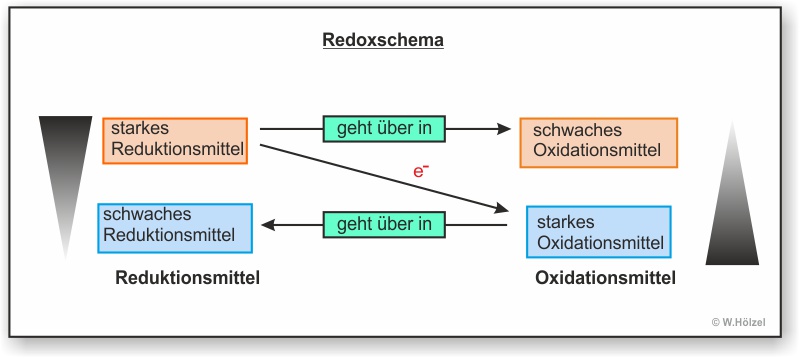
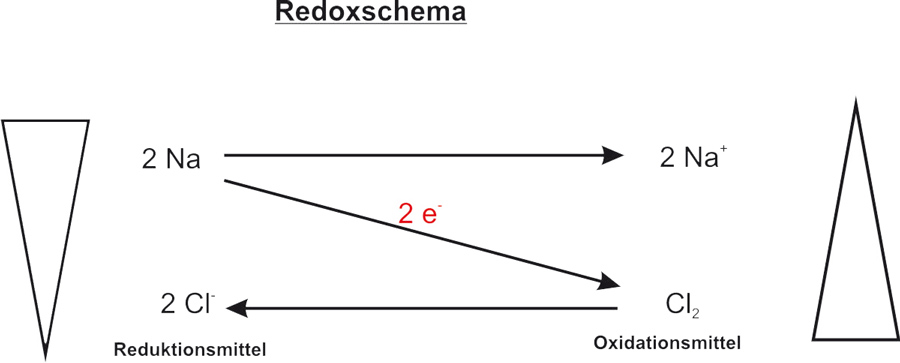
Hier erst mal das Redoxschema einer freiwillig ablaufenden Reaktion (Bergabreaktion). Mit Hilfe eines Redoxschemas kann man eine Reaktion veranschaulichen. Auf dem diagonalen Pfeil schreibt man die Anzahl der Elektronen, die von einem Stoff (bzw. Teilchen) zu einem anderen Teilchen übergehen. Oben links steht das Teilchen, welches die Elektronen abgibt. Wenn dieses Teilchen diese Elektronen abgibt verändert es sich selbst (Natrium ist zum Beispiel ein sehr reaktives Metall; Natrium-Kation hingegeben ist reaktionsarm und wir nutzen es als Bestandteil des Speisesalzs). Das oxidierte Teilchen wird oben rechts geschrieben.
Unten rechts steht das Teilchen, welches Elektronen aufnimmt. Auch dieses Teilchen verändert sich dabei. Das Ergebnis steht dann unten links.
II. Mg + O2

d) Teilgleichungen
Gerade bei komplizierten Redoxgleichungen, kann es eine Hilfe sein, dass man die Reaktionsgleichungen in die Teilreaktionen Oxidation und Reduktion aufsplittet. Das Ergebnis für die Verbrennung von Magnesium sind man in den folgenden Teilgleichungen. Da die Anzahl der aufgenommenen und abgegebenen Elektronen gleich sein muss, multipliziert man die Oxidationsreaktion mit zwei. Dadurch geben zwei Magnesium-Atome vier Elektronen ab (siehe Redox) und das Sauerstoffmolekül nimmt vier Elektronen auf.
Oxidation: Mg → Mg2+ + 2 e- | · 2
Reduktion: O2 + 4 e- → 2 O2- | · 1
---------------------------------------------------
Redox: 2 Mg + O2 → 2 Mg2+ + 2 O2-
- Details
- Geschrieben von: Wolfram Hölzel
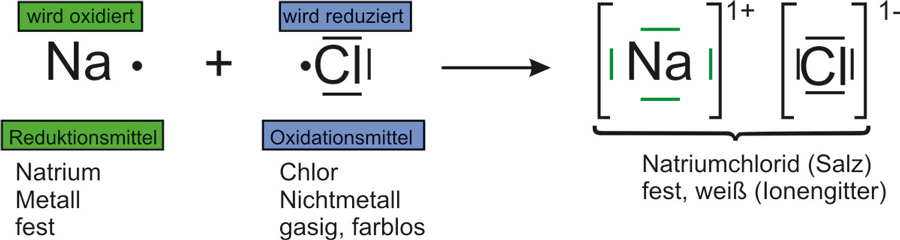
1.2 Natrium reagiert mit Chlor
Wichtiger Tipp: Durch Elektronenabgabe oder Aufnahme können Ionen entstehen, die Edelgaskonfiguration in der Elektronenhülle aufweisen.
- Formuliert die Teilreaktionen (Oxidation und Reduktion).
- Formuliert die Gesamtreaktion.
- Zeichnet ein vollständiges Redoxschema für diese Reaktion.
{slider title="Lösung" open="false" class="icon"}
Oxidation: Na → Na¹⁺ + 1 e⁻ | · 2
Reduktion: Cl₂ + 2 e⁻ → 2 Cl¹⁻ | · 1
-------------------------------------------
Redox: 2 Na + Cl₂ → 2 Na¹⁺ + 2 Cl¹⁻
Reaktionsgleichung: 2 Na + Cl₂ → 2 NaCl ΔH < 0
{/sliders}
- Details
- Geschrieben von: Wolfram Hölzel
1.3 Neue Definitionen
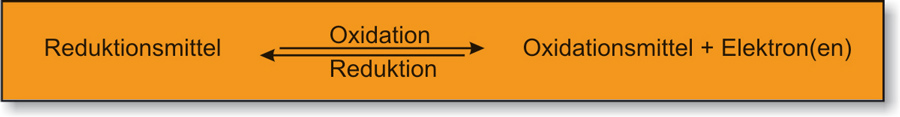
Oxidation = Elektronenabgabe
Reduktion = Elektronenaufnahme
Redoxreaktionen: Reaktionen mit Elektronenübertragung.
Oxidation und Reduktion laufen gleichzeitig ab.
Oxidationsmittel: Elektronenakzeptor („Elektronenräuber“)
Reduktionsmittel: Elektronendonator („ Elektronenspender“) [ nicht freiwillig ]
Merke: Ein Oxidationsmittel oxidiert ein anderes Teilchen und wird dabei selber reduziert.
Ein Reduktionsmittel gibt Elektronen ab, die es später wieder aufnehmen kann. Es wird also zu einem Oxidationsmittel.
Redoxpaar: z.B.
![]()
Jede Redoxreaktion man formal in zwei Teilreaktionen zerlegen:
(1) Oxidation (Elektronenabgabe)
(2) Reduktion (Elektronenaufnahme).
Beispiel: Lithium reagiert mit Chlor
(1) Oxidation: Li → Li⁺ + 1 e⁻ | · 2
(2) Reduktion: Cl₂ + 2 e⁻ → 2 Cl⁻ | · 1
______________________________________________________
Teilchengleichung: 2 Li + Cl₂ → 2 Li⁺ + 2 Cl⁻
Reaktionsgleichung: 2 Li(s) + Cl₂ (g) → 2 LiCl(s) ΔH < 0
Achtung:
Die Zahl der abgegebenen und aufgenommenen Elektronen muss gleich sein; die Elektronenbilanz muss stimmen (gemeinsames Vielfaches!).
Aus diesem Grund muss man das Teilschema (1) mit dem Faktor 2 multiplizieren
Die Formel für das Salz LiCl besagt, dass im festen LiCl, die Lithium-Ionen und die Chlorid-Ionen im Stoffmengenverhältnis
n(Li⁺) : n(Cl-) = 1 : 1 vorhanden sind.
Aufgaben:
Formuliere für folgende Reaktionen
- die Teilreaktionen.
- Stelle abschließend jeweils die Teilchengleichung und die
- Reaktionsgleichung auf.
- Achte darauf, welche Elemente molekular vorkommen und formuliere die Molekülformel auch in den Teilreaktionen.
a) Magnesium + Chlor
b) Aluminium + Sauerstoff
a) Magnesium + Chlor
{slider title="Lösung" open="false" class="icon"}
(1) Oxidation: Mg → Mg²⁺ + 2 e⁻ | · 1
(2) Reduktion: Cl₂ + 2 e⁻ → 2 Cl⁻ | · 1
-----------------------------------------------------------------------------------------
Teilchengleichung: Mg + Cl₂ → Mg²⁺ + 2 Cl⁻
Reaktionsgleichung: Mg + Cl₂ → MgCl₂
Die Formel für das Salz MgCl₂ besagt, dass im festen Magnesiumchlorid, die Magnesium-Ionen und die Chlorid-Ionen im Stoffmengenverhältnis n(Mg²⁺) : n(Cl-) = 1 : 2 vorhanden sind.
{/sliders}
b) Aluminium + Sauerstoff
{slider title="Lösung" open="false" class="icon"}
(1) Oxidation: Al → Al³⁺ + 3 e⁻ | · 4
(2) Reduktion: O₂ + 4 e⁻ → 2O²⁻ | · 3
---------------------------------------------------------------------------------
Teilchengleichung: 4 Al + 3 O₂ → 4 Al³⁺ + 6 O²⁻
Reaktionsgleichung: 4 Al + 3 O₂ → 2 Al₂O₃
Das Ionengitter des Aluminiumoxids ist elektrisch neutral, wenn auf zwei Aluminium-Ionen (Al³⁺) drei Oxid-Ionen (O²⁻) entfallen. Das Anzahlverhältnis muss 2 : 3 lauten: (Al³⁺)₂(O²⁻)₃ oder Al₂O₃ (Verhältnisformel).
{/sliders}
Verhältnisformeln der Salze geben das Zahlenverhältnis der Ionen im Ionengitter an!
- Details
- Geschrieben von: Wolfram Hölzel
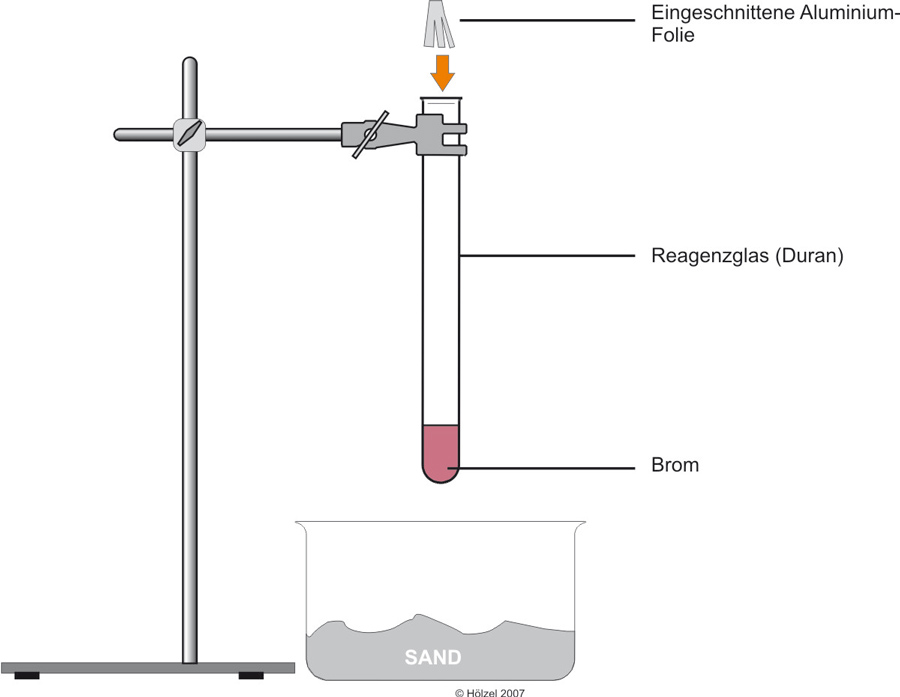
1.4 Aluminium + Brom
- Formuliert die Teilreaktionen (Oxidation und Reduktion).
- Formuliert die Gesamtreaktion.
- Zeichnet ein vollständiges Redoxschema für diese Reaktion.
{slider title="Lösung" open="false" class="icon"}
Die Zahl der abgegebenen und aufgenommenen Elektronen muss gleich sein; die Teilchengleichung (2) muss deshalb mit dem Faktor 3 multipliziert werden.
Für die Teilchengleichung benötigt man ganze Zahlen (1,5 Brom-Moleküle gibt es nicht!). Deshalb wird die Gleichung (3) mit dem Faktor 2 multipliziert.
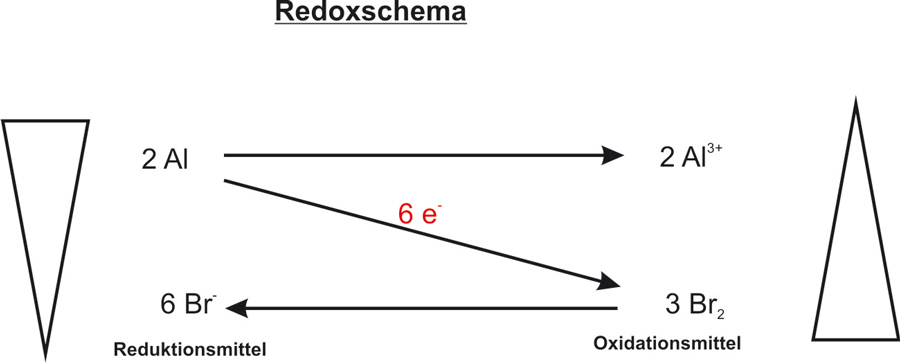
Teilchengleichung: 2 Al + 3 Br₂ → 2 Al³⁺ + 6 Br⁻
Reaktionsgleichung: 2 Al + 3 Br₂ → 2 AlBr₃ ΔH < 0
Redoxschema:
{/sliders}
Übungen:
Formuliere für folgende Reaktionen die Teilreaktionen. Stelle abschließend jeweils die Teilchengleichung und die Reaktionsgleichung auf. Achte darauf, welche Elemente molekular vorkommen und formuliere die Molekülformel auch in den Teilreaktionen.
- Magnesium + Chlor
- Aluminium + Sauerstoff
Lösungen: Um die Lösung zu sehen, muss der Bereich darunter "markiert" werden (z.B. durch Links-Klick und ziehen über den unteren Bereich mit der Maus).
a. Magnesium + Chlor
(1) Oxidation: Mg → Mg²⁺ + 2 e⁻ | · 1
(2) Reduktion: Cl₂ + 2 e⁻ → 2 Cl⁻ | · 1
-----------------------------------------------------------------------------------------
Teilchengleichung: Mg + Cl₂ → Mg²⁺ + 2 Cl⁻
Reaktionsgleichung: Mg + Cl₂ → MgCl₂
Die Formel für das Salz MgCl₂ besagt, dass im festen Magnesiumchlorid, die Magnesium-Ionen und die Chlorid-Ionen im Stoffmengenverhältnis n(Mg²⁺) : n(Cl-) = 1 : 2 vorhanden sind.
b. Aluminium + Sauerstoff
(1) Oxidation: Al → Al³⁺ + 3 e⁻ | · 4
(2) Reduktion: O₂ + 4 e⁻ → 4 O²⁻ | · 3
---------------------------------------------------------------------------------
Teilchengleichung: 4 Al + 3 O₂ → 4 Al³⁺ + 6 O²⁻
Reaktionsgleichung: 4 Al + 3 O₂ → 2 Al₂O₃
Das Ionengitter des Aluminiumoxids ist elektrisch neutral, wenn auf zwei Aluminium-Ionen (Al³⁺) drei Oxid-Ionen (O²⁻) entfallen. Das Anzahlverhältnis muss 2 : 3 lauten: (Al³⁺)₂(O²⁻)₃ oder Al₂O₃ (Verhältnisformel).
Wichtig: Verhältnisformeln der Salze geben das Zahlenverhältnis der Ionen im Ionengitter an.
- Details
- Geschrieben von: Wolfram Hölzel
1.5 Ionenladungen und Formeln von Ionenverbindungen (Salzen)
Anzahl der positiven Elementarladungen muss mit der Anzahl der negativen Elementarladungen im Ionengitter übereinstimmen. Formeln für Salze geben an, in welchem Anzahlverhältnis die beteiligten Ionen im Ionengitter vorliegen. Es handelt sich um Verhältnisformeln.
Bsp.:
- Natriumchlorid besteht aus Na¹⁺- und Cl¹⁻-Ionen: Verhältnisformel: NaCl
- Magnesiumbromid besteht aus Mg²⁺- und Br¹⁻-Ionen: Verhältnisformel: MgBr₂
- Aluminiumoxid besteht aus Al³⁺- und O²⁻-Ionen: Verhältnisformel: Al₂O₃
- Natriumsulfid besteht aus Na¹⁺- und S²⁻-Ionen: Verhältnisformel: Na₂S
- Calciumnitrid besteht aus Ca²⁺- und N³⁻-Ionen: Verhältnisformel: Ca₃N₂
1. Hinweis: Wenn keine Zahl da steht (wie z.B. beim Kochsalz NaCl, muss man sich eine "1" denken: Na₁Cl₁).
2. Hinweis: Man bekommt die gemeinsame Ladung recht schnell heraus: Ca²⁺- und N³⁻-Ionen -> Ca₃N₂ -> Die Ladungsanzahl einfach beim anders geladenen Partner in den Index schreiben.
Falls man das nochmals etwas genauer wiederholen möchte: Hier die Grundlagen dazu: Ionenbindung - PSE - Verhältnisformel.
- Details
- Geschrieben von: Wolfram Hölzel