5 Proteine
5.1 Aminosäure
5.1.1 Vorkommen
Die Aminosäuren kommen im pflanzlichen und tierischen Organismus frei und gebunden vor. Aminosäuren sind Bauelemente der Eiweißstoffe (Proteine).
5.1.2 Funktionelle Gruppen
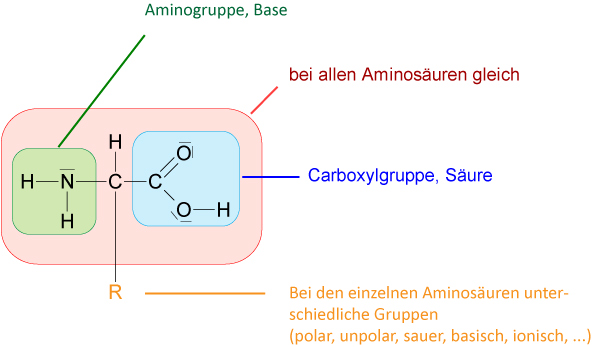
Aminosäuren enthalten (formal) Amino- und Carboxyl-Gruppen.
5.1.3 Aminoessigsäure (Glycin)
[1819 entdeckt]
Fischer-Projektion
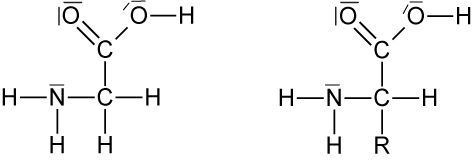
L-Glycin α-L-Aminosäuren
Merke: Alle Aminosäuren, die in Proteinen gefunden werden, besitzen die L-Konfiguration. Weiterhin steht die Aminogruppe bei allen Aminosäuren, die aus natürlich vorkommenden Proteinen gewonnen werden, am α-C-Atom (2-Aminocarbonsäuren sind α-Aminsäuren).
Enantiomere (optische Antipoden) Verhalten sich wie Bild und Spiegelbild
5.1.4 Gleichgewicht
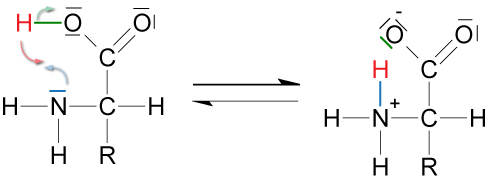
Aminosäureform Zwitterionenform
Die Zwitterionenform wird begünstigt:
- im Kristall (100 %) durch höhere Gitterenergie;
- in wässriger Lösung (99%) durch höhere Hydrationsenergie
Für das Vorliegen der Zwitterionenform im Kristall spricht u.a. der abnorm hohe Schmelzpunkt von Glycin (bei 230 °C unter Zersetzung).
Zum Vergleich die Schmelzpunkte von:
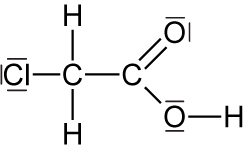
Chloressigsäure: 62°C
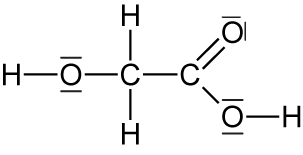
Hydroxyessigsäure: 78°C
5.1.5 Herstellung von Glycin aus Chloressigsäure + Ammoniak
In der 1. Stufe wird Chloressigsäure deprotoniert:
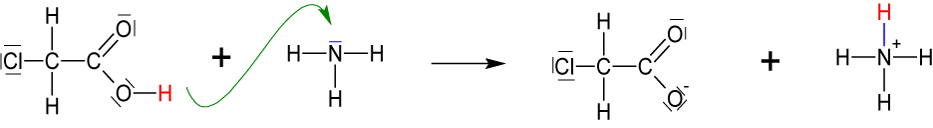
Das entstandene Anion reagiert mit dem überschüssigen Ammoniak weiter:

- Details
- Geschrieben von: Wolfram Hölzel
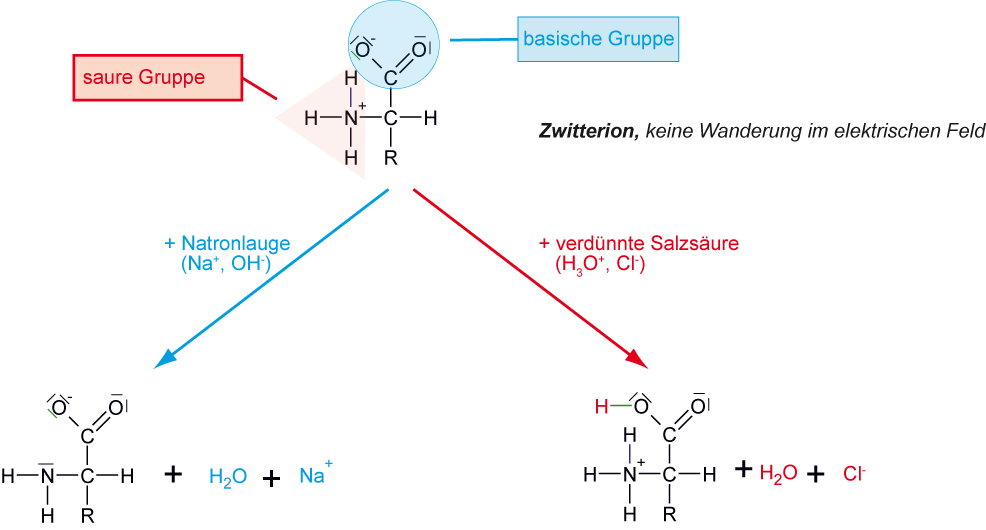
5.1.6 Aminosäure sind Ampholyte
Aminosäuren können sowohl als Brønsted-Säuren als auch als Brønsted-Basen reagieren.
Die hinzugefügten Oxonium- und Hydroxid-Ionen werden abgefangen. Der pH-Wert verändert sich kaum. Aminosäuren besitzen Pufferwirkung.
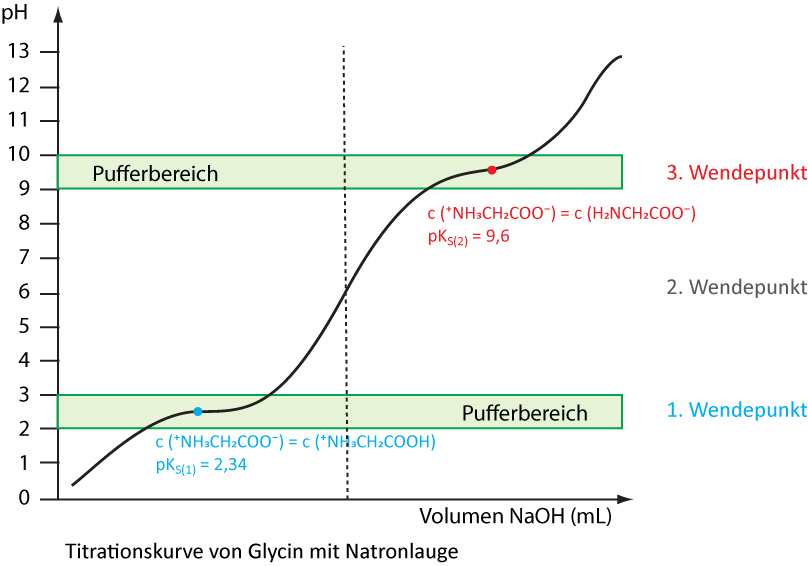
1. Wendepunkt
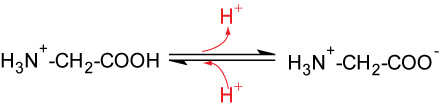
50 % 50 %
pKS1 = 2,34
Für jede Aminosäure gibt es einen pH-Wert, bei dem sie im elektrischen Feld nicht wandert. Diesen pH-Wert bezeichnet man als isoelektrischen Punkt. Bei diesem Punkt liegen praktisch nur die Zwitterionen vor. Der isoelektrische Punkt bei Glycin liegt bei pH 6,0 (2. Wendepunkt).
3. Wendepunkt
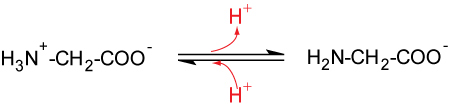
50 % 50 %
pKS2 = 9,77
- Details
- Geschrieben von: Wolfram Hölzel
5.1.7 Isoelektrischer Punkt
Leitfähigkeitstitration = Konduktometrie
Problem: Wie verhalten sich die drei Glycin-Lösungen mit unterschiedlichen pH-Wert beim Leitfähigkeitsversuch?
Versuch: Leitfähigkeitsmessungen mit folgenden drei Lösungen:
- 40 mL Glycin-Lösungen (c = 0,1 mol/L) + 20 mL Salzsäure (c = 1 mol/L)
- 40 mL Glycin-Lösungen (c = 0,1 mol/L) + 20 mL Natronlauge (c = 1 mol/L)
- 60 mL Glycin-Lösung (c = 0,1 mol/L)
Ergebnis: Von den 3 untersuchten Glycin-Lösungen leiten die alkalische und saure Lösung den elektrischen Strom. Die wässrige Glycin-Lösung (pH-Wert ca. 6,0) zeigt (fast) keine Leitfähigkeit.
Isoelektrischer Punkt: Der pH-Wert bei dem eine Aminosäure ihre minimalste elektrische Leitfähigkeit zeigt, ist der isoelektrische Punkt (IEP). Die Konzentration an Zwitterionen hat hier ein Maximum erreicht.
Leitfähigkeit der verschiedenen Ionen:
| Ionensorte | Leitfähigkeit bei 25°C in S∙cm²/mol |
| H₃O⁺ (aq) | 350 |
| OH⁻ (aq) | 198 |
| Na⁺ (aq) | 50 |
| Cl⁻ (aq) | 76 |
Bsp.: Titration einer Salzsäure mit Natronlauge

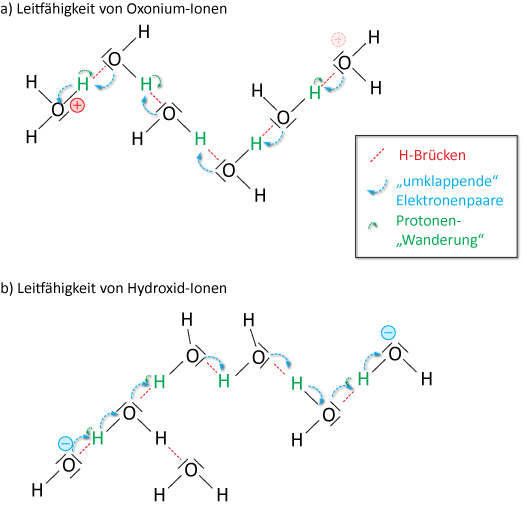
Die Leitfähigkeit Κ setzt sich additiv aus den Einzelleitfähigkeiten aller vorhandenen Ionen zusammen. Bei Oxonium- und Hydroxid-Ionen „klappen dabei H-Brücken um“.
Dissoziation der gelösten Stoffe, die im elektrischen Feld
wandern, abhängig von:
- Anzahl der Ionen (Konzentration)
- Anzahl der Elementarteilchen pro Ion
- Wanderungsgeschwindigkeit ( Natur der Ionen, Größe der Solvathülle, Viskosität des Lösungsmittels, Feldstärke)
- Polarität des Lösungsmittels
- Temperatur
Den Äquivalenzpunkt findet man durch Extrapolation (niedrigster Leitfähigkeitswert)
- Details
- Geschrieben von: Wolfram Hölzel
5.1.8 Weitere Aminosäuren
Vergleiche ausgegebenes Arbeitsblatt
Essenzielle (lebenswichtige) Aminosäuren
8 Aminosäuren können nicht im menschlichen Körper synthetisierst werden. Sie müssen mit der Nahrung aufgenommen werden.
5.1.9 Nachweisreaktionen
a) Schwefelnachweise
Pb²⁺ (aq) + 2 Ac⁻ (aq) + H₂S (g) → PbS (s) + 2 HAc
Bleiacetatlsg. Schwefelwasserstoff Bleisulfid Essigsäure
schwarz
b) Ninhydrinreaktion
Ninhydrin ist ein Reagens zum Nachweis von Ammoniak und primären Aminogruppen, insbesondere von Aminosäuren.
Zwei Moleküle Ninhydrin reagieren in alkalischen Milieu mit kurzen Oligopeptiden zu einem blauen Farbstoff, Ruhmanns Violett.
- Details
- Geschrieben von: Wolfram Hölzel
5.2 Peptide
5.2.1 Herstellung
Aus Aminosäuren (exakt: Aminosäurederivaten) lassen sich Ketten- und ringförmige Peptide herstellen (zuerst E. Fischer 1903).
Schematisch (zwei gleiche Aminosäuren, z.B. Glycin)
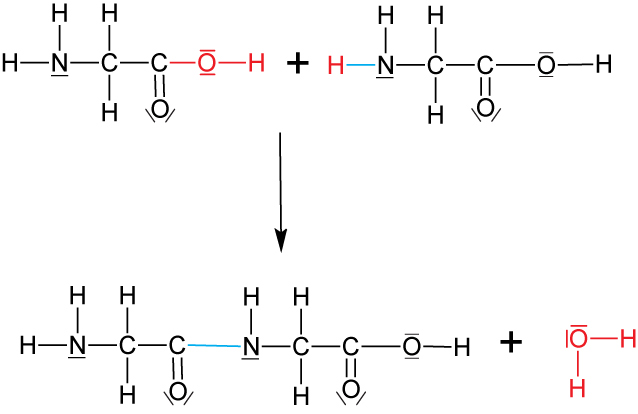
Dipeptid
Typische Kondensationsreaktion
5.2.2 Funktionelle Gruppe
Peptid-Gruppe (Säureamid-Gruppe)

(Buch: -CO-NH-)
analog der Ester-Gruppe

- keine freie Drehbarkeit der C-N-Bindung.
- C-N-Abstand ist kleiner als bei C-N-Bindung in Aminen (132 pm < 147 pm)
- alle Atome der Peptidgruppe liegen in einer Ebene
⇨ Mesomerie mit 2 mesomeren Grenzformeln
cis-trans-Isomerie
Peptide liegen immer als trans-Konfiguration vor;
Starrheit der Peptidmoleküle.
5.2.3 Glutathion (GSH, ein Tripeptid)
Aufgabe: Welche Aminosäuren erhält man durch Hydrolyse (erhitzen mit Säuren oder Alkalien) und anschließende chromatographische Trennung?
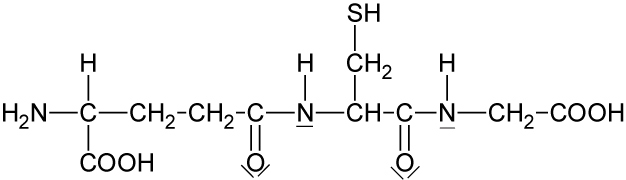
Lösung:
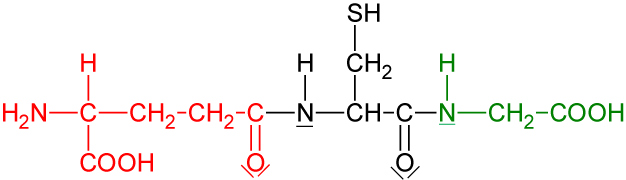
- Glutaminsäure
![]()
- Cystein
![]()
- Glycin
![]()
Vorkommen: in fast allen tierischen und pflanzlichen Zellen
Funktion: wirkt als Wasserstoffüberträger bei biochemischen Oxidations- und Reduktionsvorgängen
- Details
- Geschrieben von: Wolfram Hölzel