Naturstoffe
1 Isomerie:
Isomere[1]: Zwei Verbindungen mit gleicher Summenformel, aber unterschiedlicher chemischer Struktur. Isomere unterscheiden sich teilweise in ihren physikalischen, biologischen und chemischen Eigenschaften.

Chiral[2]: Objekte, deren Spiegelbild nicht durch Drehung mit dem Original in Deckung gebracht werden können.
Achiral: Objekte, deren Spiegelbild durch Drehung in Deckung gebracht werden können.
- Details
- Geschrieben von: Wolfram Hölzel
2 Fischer-Projektion
Regeln und Reihenfolge:
- C-Gerüst senkrecht
- höchstes oxidiertes C-Atom oben (Oxidationszahl)
- beide C-C-Bindungen am mittleren C-Atom zeigen nach hinten (hinter die Papier-Ebene)
- beide horizontale Bindungen am mittleren, asymmetrischen C-Atom (H-C-; H-O-C-Bindung) zeigen nach vorne.
- Das Isomer, bei dem die Substituentengruppe mit dem elektronegativsten Atom in der Fischer-Projektion rechts steht, wird mit D[1] bezeichnet; steht der Substituent links, dann wird er mit L[2] bezeichnet.
Beispiel
a) Milchsäure: 2 Hydroxypropansäure
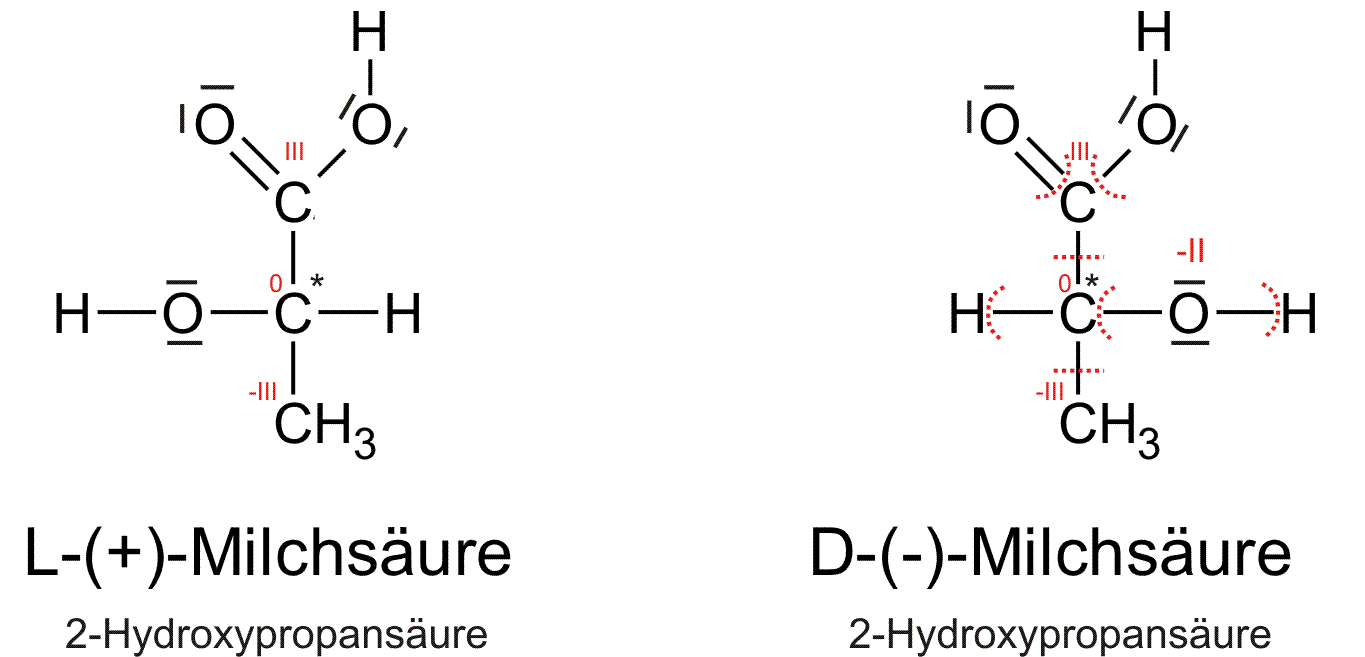
Im folgenden die D-Milchsäure

c) Weinsäure (2,3-Dihydroxybutan-1,4-Dicarbonsäure):
Wichtiger Hinweis: die zweite Weinsäure ist die D-(-)-Weinsäure. Der Name innerhalb der Abbildung ist falsch! Danke für die Korrektkur.
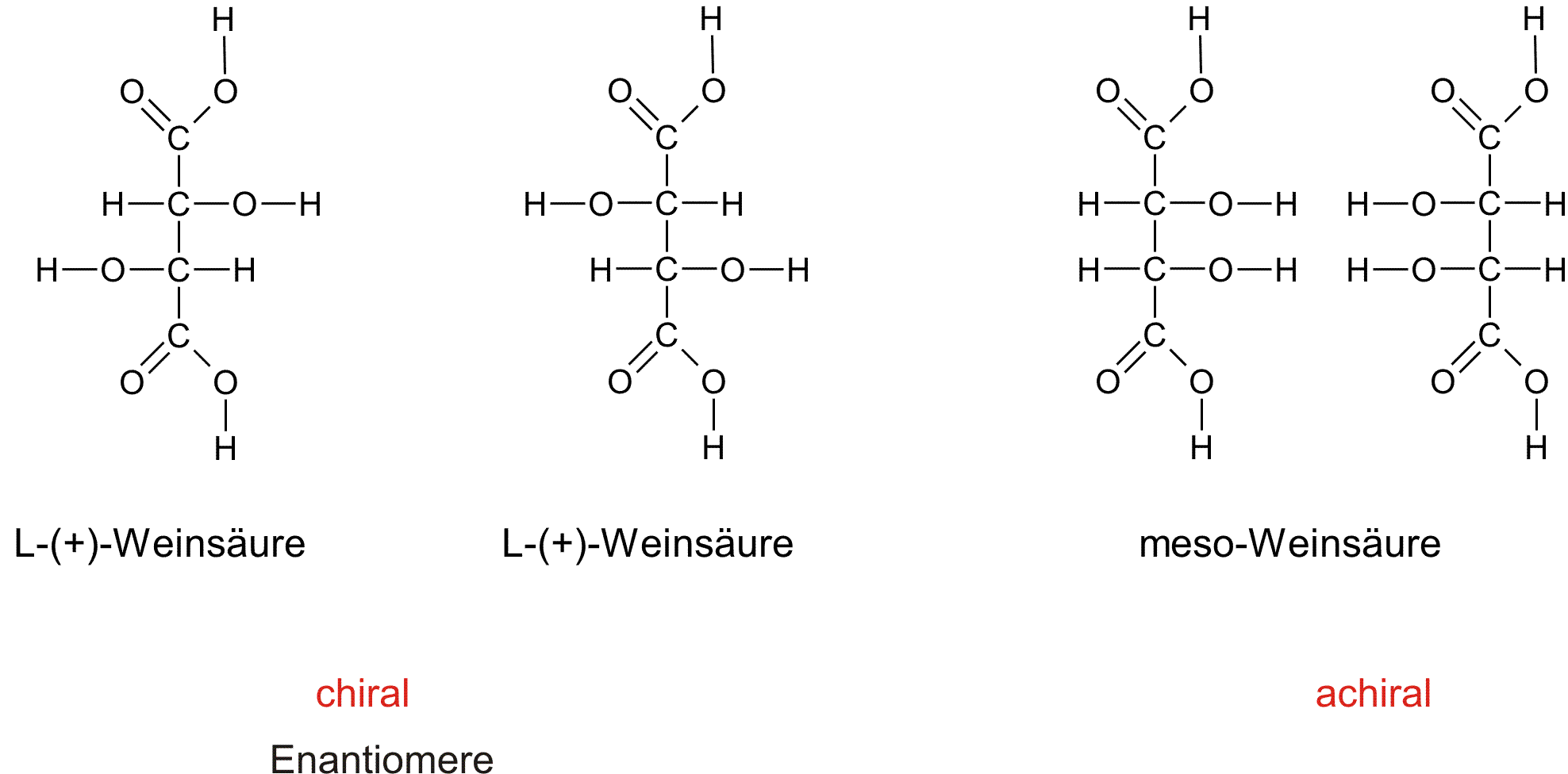
Hat eine Verbindung n asymmetrische C-Atome, so gibt es meist 2n Stereoisomere. Stereoisomere, die keine Enantiomere sind, heißen Diastereomere und haben verschiedene physikalische Eigenschaften.
Substanzen, deren Moleküle mit ihren Spiegelbildern übereinstimmen, obwohl sie Chiralitätszentranen besitzen, heißen meso-Verbindungen ("Das Spiegelbild des Originals kann durch Drehung wieder genau so aussehen, wie das Original). Sie besitzen eine Spiegelebene im Molekül.
-----------------
[1] D = dexter (lat) = rechts
[2] L = laevus (lat) = links
- Details
- Geschrieben von: Wolfram Hölzel
3. Optische Aktivität und Polarimeter
Beim Durchgang von polarisiertem Licht durch die Lösung eines Enantiomeren erfährt die Polarisationsebene eine Drehung um einen bestimmten Betrag nach rechts oder links. Das andere Enantiomere dreht die Polarisationsebene des Lichtes um den gleichen Betrag in die entgegengesetzte Richtung.
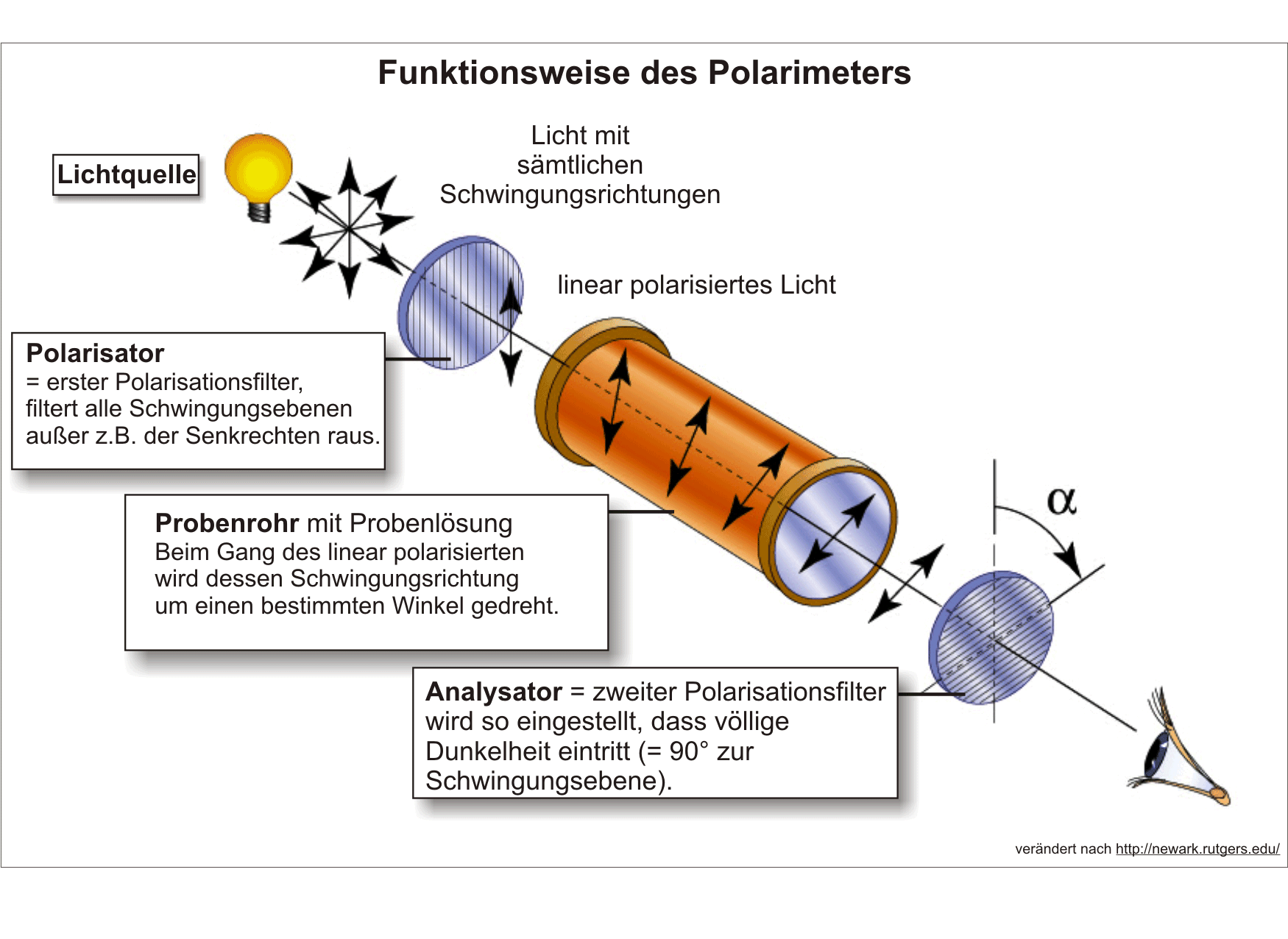
Der Drehwinkel α ist direkt proportional der:
- Massenkonzentration β
- Länge l des Probenrohrs
Der Proportionalitätsfaktor αsp hat einen für die optisch aktive Verbindung charakteristischen Wert. Er wird spezifische Drehung genannt. Sie wird bei 20 °C mit dem Licht einer Natrium-dampflampe bestimmt, das heißt mit Licht der Wellenlänge λ = 589,3 nm.
Schreibweise:
(+): rechtsdrehende Verbindungen
(-): linksdrehende Verbindung
Racemat (racemische Mischung, Raceform): äquimolares Gemisch der Enantiomere; dreht das polarisierte Licht nicht.
- Details
- Geschrieben von: Wolfram Hölzel
4 Kohlenhydrate - Einteilung der Kohlenhydrate
Name: Die meisten Verbindungen dieser Stoffklasse haben die Summenformel Cx(H2O)y.
Monosaccharide, Einfachzucker
einfache Kohlenhydrate
Bsp.: Glucose, Fructose, Galactose
Oligosaccharide
zusammengesetzte KH aus 2-8 Monosaccharide; Disaccharide umfasst die Zweifachzucker (Bsp.: Saccharose, Maltose, Lactose).
Polysaccharide
durch Polykondensation von MS entstanden.
Stärke, Glycogen, Cellulose
- Details
- Geschrieben von: Wolfram Hölzel
4.1 Monosaccharide
4.1.1 Glucose - Traubenzucker
Vorkommen: Trauben, Früchte
a) physikalische Eigenschaften
- Aggregatzustand: fest; Schmelzpunkt um 146°C; weiteres Erhitzen führt zur Zersetzung.
Folgerung: Glucose besitzt hohe zwischenmolekulare Kräfte (Vermutung: H-Brückenbindung) und van-der-Waals-Kräfte.
- Löslichkeit:
Glucose löst sich sehr gut in Wasser (67g/100ml), dagegen löst sich Glucose nicht in Benzin. Eine wässrige Glucoselösung zeigt (fast) keine elektrische Leitfähigkeit.
Folgerung: Glucose enthält polare Gruppen, die mit Wasser H-Brücken eingehen können. Es entsteht keine Ionen.
b) qualitative Elementaranalyse
Reaktion von Glucose mit konzentrierter Schwefelsäure:
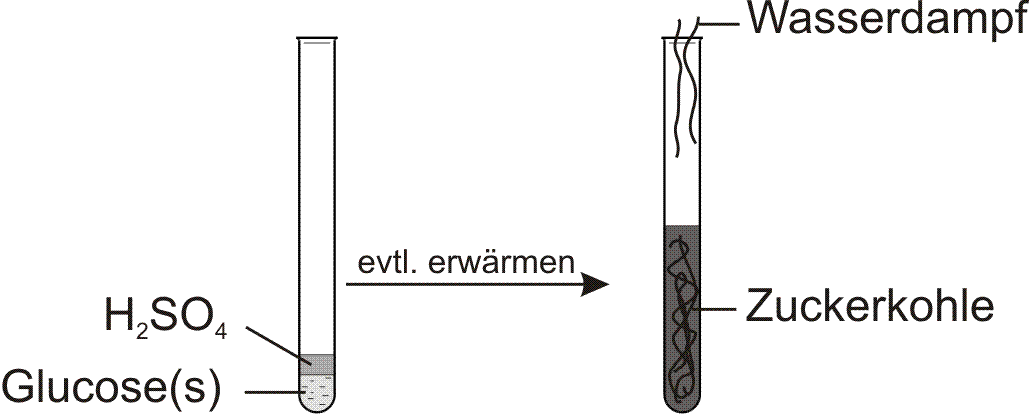
Folgerung: Glucose enthält Kohlenstoff.
Mitteilung: Glucose enthält neben C noch H und O.
c) quantitative Elementaranalyse
Die quantitative Elementaranalyse nach Liebig ergibt:
3,6 g Glucose liefert bei der Verbrennung:
- 5,28 g CO2
- 2,16 g H2O
Glucose besitzt folgende Summenformel: CnH2nOn
Von dieser allgemeinen Formel [C(H2O)]n leitet sich die Bezeichnung Kohlenhydrate ab.
Hinweis: Im Heft folgen jetzt die Arbeitsanleitung zur Strukturaufklärung (mit den diversen Experimenten). Hier folgt jedoch gleich das Ergebnis. Die Reaktionsgleichungen von Fehling und Tollens-Reagenz finden sich dann auf anderen Seiten.
Ergebnis:
Glucose ist ein Polyhydroxyaldehyd, genauer Pentahydroxyhexanal, ein Aldehydzucker oder Aldose.
Aldose = Monosaccharide, mit terminaler Carbonylgruppe (Aldehyd)
Ketosen = Monosaccharide, mit nicht endständiger Carbonylgruppe (Keton).
Fischerprojektion:
Es gelten folgende Regeln:
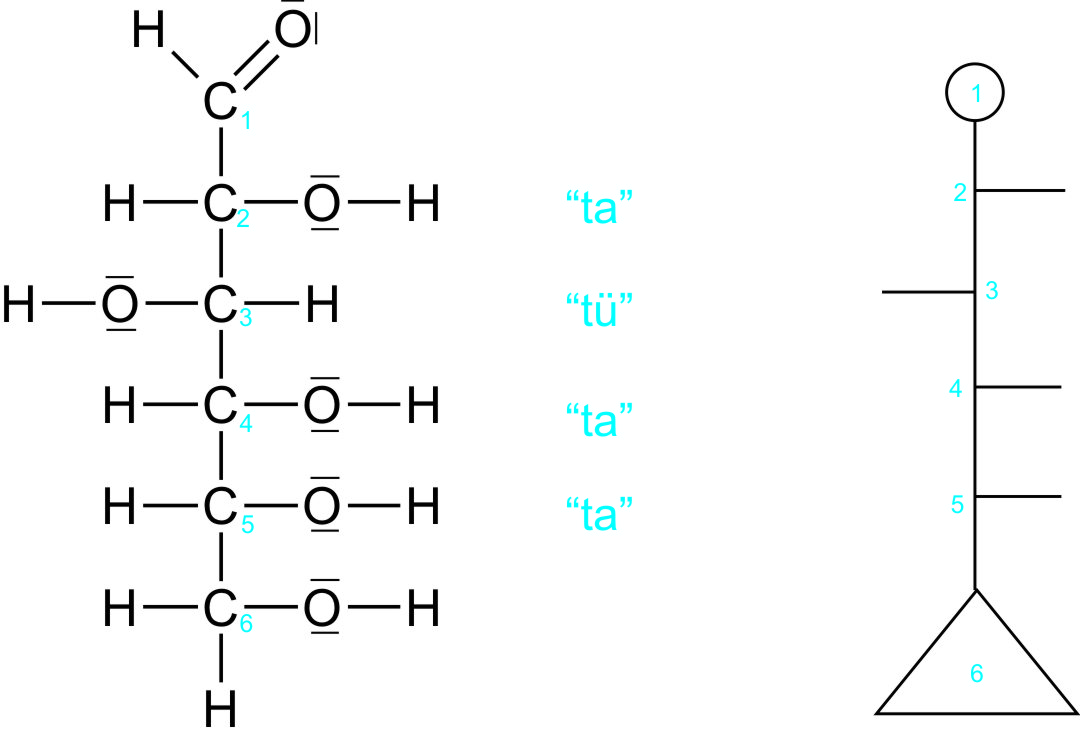
- Die C-C-Kette wird senkrecht geschrieben.
- Die am höchsten oxidierte Gruppe steht oben.
- Die C-C-Bindungen sind bei jedem C-Atom nach hinten abgewinkelt;
- dann zeigen die waagrechten Bindungen nach vorne;
- Bei der offenen Glucoseform gibt es vier asymmetrische C-Atome ==> 24-Isomere;
- Die Bezeichnung erfolgt nach dem untersten C-Atom (hier C5-Atom).
- Da die OH-Gruppe rechts steht ==> D-Konfiguration.
- ==> D-(+)-Glucose
(L-Glucose erhält man nur synthetisch)
Bildung von Glucose:
Bei Pflanzen (Fotosynthese) und Tieren (durch Abbau von anderen Molekülen).
Fotosynthese:
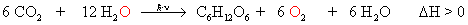
60 Mrd t Kohlenstoff werden dabei im Jahr gebunden.
Abbau von Glucose:
Bei der Zellatmung (Pflanzen, Pilze, Tiere)

- Details
- Geschrieben von: Wolfram Hölzel
